
7.同主族两种元素原子核外电子数差值可能为 ( ) A.6 B.12 C.26 D.30
A.6 B.12 C.26 D.30
6.n mol H2与n mol T2气体不同之处是 ( )
A.物质的量 B.原子数 C.质量 D.体积(相同状况)
5.与主族元素在元素周期表中所处的位置有关的是 ( )
A.相对原子质量 B.核内中子数 C.次外层电子数 D.电子层数和最外层电子数
4.某元素原子核内质子数为m,中子数为n,则下列论断正确的是 ( )
A.不能由此确定该元素的相对原子质量B.可确定该元素在元素周期表中的位置
C.可预测该元素的主要化学性质D.该元素原子核内中子的总质量小于质子的总质量
3.周期表中16号元素与4号元素的原子相比较,前者的下列数据是后者4倍的是( )
A.K层电子数 B.最外层电子数 C.电子层数 D.次外层电子数
2.据报道,166 67Ho可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为 ( )
A.32 B.67 C.99 D.166
1.钛(Ti)金属常被称为未来钢铁。钛元素的同位素46 22Ti、47 22Ti、48 22Ti、49 22Ti、50 22Ti中,中子数不可能为 ( )
A.28 B.30 C.26 D.24
3.位置与性质关系:同位置--化学性质相同,同主族--相似性、递变性;同周期--相似性、递变性。
 [典型例题]
[典型例题]
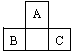
[例1]A、B、C为短周期元素,它们的位置关系如图所示,已知B、C两元素原子序数之和是A元素的原子序数的4倍,则A、B、C的元素符号分别:A__________、B______、C_______。A的原子结构示意图为_________,B在周期表中的位置______,C的离子结构示意图为________,A的氢化物分子式为_________;B、C的最高价氧化物水化物的分子式分别为_______、_________,它们的酸性_______比________强。
[例2]X和Y的原子序数都小于18,两者都能组合化合物X2Y3,已知X的原子序数为n,则Y的原子序数不可能是:
A、n+11 B、n-5 C、n+3 D、n-6
[例3]下表是元素周期表的一部分,回答下列有关问题:
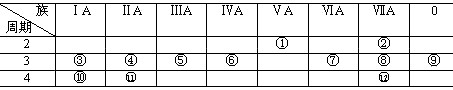
⑴写出下列元素符号:① ,⑥ ,⑦ , 11 。
⑵在这些元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
⑶在这些元素的最高价氧化物对应水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的氢氧化物是 ,写出三者之间相互反应的化学方程式:
⑷在这些元素中,原子半径最小的是 ,原子半径最大的是 。
⑸在③与④中,化学性质较活泼的是 ,怎样用化学实验证明?
⑹在⑧与 12 中,化学性质较活泼的是 ,怎样用化学实验证明?
[课后巩固]
2.结构与性质关系:电子层结构与原子半径、离子半径、电子得失难易、化合价的关系
1.位置与结构关系:原子序数=质子数;周期数=电子层数;主族序数=最外层电子数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com