
13.在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,每摩尔CuSO4能氧化P的物质的量为( )
A.1/5 mol B.2/5 mol
C.3/5mol D.11/5 mol
12.元素处于基态时的气态原子获得一个电子成为-1价阴离子时所放出的能量叫做该元素的第一电子亲合能。-1价阴离子再获得一个电子的能量变化叫做第二电子亲合能。下表中给出了几种元素或离子的电子亲合能数据;:
|
元素 |
Li |
Na |
K |
O |
O- |
F |
|
电子亲合能/kJ·mol-1 |
59.8 |
52.7 |
48.4 |
141 |
-780 |
327.9 |
下列说法正确的是 ( )
A.电子亲合能越大,说明越难得到电子
B.一个基态的气态氟原子得到一个电子成为氟离子时放出327.9kJ的能量
C.氧元素的第二电子亲合能是-780kJ·mol-1
D.基态的气态氧原子得到两个电子成为O2-需要吸收能量
11.已知H2O2的分子空间结构可在二面角中表示,如图所示。在有关H2O2结构的说法中正确的是
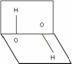 A. 分子的正、负电荷中心重合
A. 分子的正、负电荷中心重合
B. 分子的正、负电荷中心不重合
C. H2O2是极性分子
D. H2O2是非极性分子
10.下列物质的变化规律,与共价键的键能有关的是
A.F2、Cl2、Br2、I2的熔、沸点逐渐升高
B.HF、HCl、HBr、HI的热稳定性依次减弱
C.金刚石的硬度、熔点、沸点都高于晶体硅
D.NaF、NaCl、NaBr、NaI的熔点依次降低
9.用NA表示阿伏加德罗常数的值。下列叙述正确的是
 A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
A.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
B.标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C.32 g S8单质中含有的S-S键个数为NA
 D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
D.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA
8.下列说法正确的是
A.在分子中,两个成键的原子间的距离叫做键长
B.H-Cl的键能为431.8kJ/mol,H-I的键能为298.7kJ/mol,这可以说明HCl分子比HI分子稳定
C.含有极性键的分子一定是极性分子
D.键能越大,表示该分子越容易受热分解
7.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A.X与Y形成化合物时,X显负价,Y显正价
B.第一电离能Y一定小于X
C.最高价含氧酸的酸性:X对应的酸性强于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
6.对Na、Mg、Al的有关性质的叙述不正确的是
A.第一电离能:Na< Mg <Al
B.电负性:Na< Mg< Al
C.还原性:Na> Mg >Al
D.碱性:NaOH> Mg(OH)2> Al(OH)3
5.下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;
③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;
⑤N和O元素的第一电离能;⑥H 原子和H+离子的半径
A.①④⑤ B.②④⑥ C.④⑤⑥ D.③⑤⑥
4.下列说法中,正确的是
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B. 在周期表里,元素所在的周期数等于原子核外电子层数
C.最外层电子数为8的粒子都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com