
23. (6分)某钙钛型复合氧化物(如右图),
(6分)某钙钛型复合氧化物(如右图),
以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,
当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
⑴用A、B、O表示这类特殊晶体的化学式: 。
 ⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,
(x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,
(x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,
则La1-xAxMnO3中三价锰与四价锰的物质的量之比为: (用含x的代数式表示)
⑶下列有关说法正确的是 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如右图:
22.(8分)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(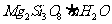 )等化合物。
)等化合物。
(1)某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
(2)铝元素的原子核外共有__ ___种不同运动状态的电子、_______种不同能级的电子。
(3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径
(填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:_____ _
(4)Al2O3、Mg0和SiO2都可以制耐火材料, 其原因是______。
a、Al2O3、Mg0和SiO2都不溶于水 b.Al2O3、Mg0和SiO2都是白色固体
 c.Al2O3、Mg0和SiO2都是氧化物 d.Al2O3、Mg0和SiO2都有很高的熔点
c.Al2O3、Mg0和SiO2都是氧化物 d.Al2O3、Mg0和SiO2都有很高的熔点
21.(12分)三氟化氮是一种无色、无味、无毒且不可燃的气体,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。NF3是一种三角锥型分子,键角102°,沸点-129°C;可在铜的催化作用下由F2和过量NH3反应得到。
(1)写出制备NF3的化学反应方程式: 。
(3)与铜属于同一周期,且未成对价电子数最多的元素基态原子核外电子简化排布式为
。
(4)理论上HF、NaAlO2和NaCl按6:1:2的物质的量之比恰好反应生成HCl、H2O和一种微溶于水的重要原料,该物质含有三种元素,在金属铝的冶炼中有重要作用。该物质为配合物,其中心离子是 ,配位数为 。
(5)含氧酸可表示为:(HO)mROn,酸的强度与酸中的非羟基氧原子数n有关,n越大,酸性越强。一般n=0 弱酸,n=1 中强酸,n=2强酸,n=3 超强酸。
据实验事实可知硼酸(H3BO3)是弱酸,而亚磷酸是中强酸(H3PO3)
(1) 写出两种酸的结构式: 、 。
(2)写出亚磷酸过量的NaOH反应的方程式.
_____________________________________________________________________。
20.(12分)已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期。A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1︰1的化合物N是常见的有机溶剂。E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
 (1)E的基态原子的外围电子排布式为
。
(1)E的基态原子的外围电子排布式为
。
(2)下列叙述正确的是 。(填字母)
a.M易溶于水,是因为M与水分子间能形成氢键,且M
是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
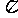
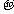 c.N分子中含有6个 键和1个 键
c.N分子中含有6个 键和1个 键
d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
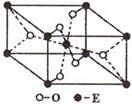
(3)E的一种氧化物Q,其晶胞结构如右上图所示,则Q的化学式为 ,该晶体中氧原子的配位数为 。
(4)在浓的ECl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为ECl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1︰5,则该配离子的化学式为 。
(5)某固体R的化学式为CA5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试完成下列问题。
①固体R的电子式为____________。
②R溶于水后有气体生成写出所发生的化学方程式___________________________。
19.(8分)砷化镓(GaAs)属于第三代半导体,用它制造的灯泡寿命是普通灯泡的100倍,而耗能只有其10%。推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。砷化镓的晶胞结构如右图。试回答:
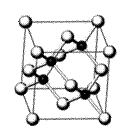 (1)As的核外电子排布式为 。
(1)As的核外电子排布式为 。
(2)砷化镓晶胞中所包含的Ga原子个数为 。
(3)下列说法正确的是 (填字母)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga
C.电负性:As>Ga D.砷化镓晶体中含有配位键
(4)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法在700℃时制备得到。AsH3的空间形状为 ,(CH3)3Ga中镓原子的杂化方式为 。
(5)AsH3沸点比NH3低,其主要原因是 。
18.(6分)向盛有KI溶液的试管中加入少许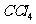 后滴加氯水,
后滴加氯水,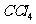 层
层 变成紫色。如果继续向试管中滴加氯水,振荡,
变成紫色。如果继续向试管中滴加氯水,振荡,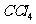 层会逐渐变浅,最后变成无色。
层会逐渐变浅,最后变成无色。
完成下列填空:
1) 写出并配平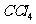
 层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
2)把KL换成KBr,则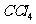 层变为红棕色:继续滴加氯水,
层变为红棕色:继续滴加氯水,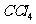 层的颜色没有变化。
层的颜色没有变化。 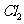 、
、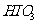 、
、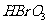 氧化性由强到弱的顺序是
。
氧化性由强到弱的顺序是
。
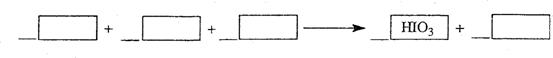
3)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含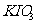 的食盐)1000kg,若庄Kl与
的食盐)1000kg,若庄Kl与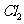 反应制
反应制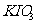 ,至少需要消耗
,至少需要消耗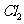 ________L(标准状况,保留2位小数)
________L(标准状况,保留2位小数)
17.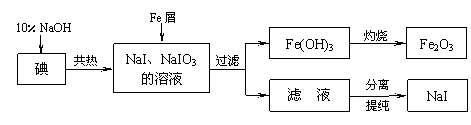 (8分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(8分)碘化钠是实验室中常用的分析试剂,也常用于医疗和照相业。工业上用铁屑还原法制备NaI,其主要流程如下图,请回答下列问题:
(1)判断碘是否已完全反应的实验方法是 ;
(2)将滤液在低温下分离出NaI样品的过程中,要防止NaI被氧化,最好采取的措施是
;
(3)测定产品中NaI含量的方法是:a.称取3.000 g样品、溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.1000 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为19.00 mL。
① 上述测定过程所需仪器中,需要检查是否漏液的仪器有 。
② 上述样品中NaI的质量分数为 。
16.下列离子方程式正确的是 ( )
 A.向银氨溶液中滴加盐酸:[Ag(NH3)2]+
+ OHˉ + 3H+ = Ag+ + 2NH4+ +
H2O
A.向银氨溶液中滴加盐酸:[Ag(NH3)2]+
+ OHˉ + 3H+ = Ag+ + 2NH4+ +
H2O
 B.Fe(OH)3溶于氢碘酸:2Fe(OH)3 + 6H+ + 2Iˉ = 2Fe2+ + I2 + 6H2O
B.Fe(OH)3溶于氢碘酸:2Fe(OH)3 + 6H+ + 2Iˉ = 2Fe2+ + I2 + 6H2O
 C.向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42ˉ离子沉淀完全
C.向硫酸铝铵[NH4Al(SO4)2]溶液中加入氢氧化钡溶液至SO42ˉ离子沉淀完全
Al3+ + 2SO42ˉ + 2Ba2+ + 4OHˉ = AlO2ˉ + 2BaSO4↓+ 2H2O
 D.向Na2S2O3溶液中通入足量氯气:S2O32ˉ+2Cl2+3H2O=2SO32ˉ+4Clˉ+6H+
D.向Na2S2O3溶液中通入足量氯气:S2O32ˉ+2Cl2+3H2O=2SO32ˉ+4Clˉ+6H+
第II卷 非选择题(72分)
15.甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含l8个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是
A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应
B.乙和甲中同种元素的质量分数相等,则乙中一定含有-l价的元素
C.丙与氧气的摩尔质量相同,则丙一定含有极性键和非极性键
D.丁中含有第2周期ⅣA族的元素,则丁一定是甲烷的同系物
14.在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液:Ca2+、H+、Cl-、HSO3-
B.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C.AlCl3溶液:K+、Na+、SO42-、AlO2-
D.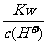 =0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com