
3. It is generally believed that reading is_________ it is a science. (01全国)
A. an art much as B. much an art as C. as an art much as D. as much an art as
2. It's always difficult being in a foreign country, _____if you don't speak the language. (2000全国)
A.extremely B.naturally C.basically D.especially
1. _______to take this adventure course will certainly learn a lot of useful skills. (2000全国)
A.Brave enough students B.Enough brave students
C.Students brave enough D.Students enough brave
7.(2010天津卷)(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
解析:(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
(2) N和H 1:3构成的分子为NH3,电子式为 ;2:4构成的分子为N2H4,其结构式为
;2:4构成的分子为N2H4,其结构式为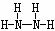 。
。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:2、8 、18、6,故其原子序数为34;其最高价氧化物对应的水化物的化学式类似H2SO4,为H2SeO4。
非金属性越强,与氢气反应放出的热量越多,故2→5周期放出的热量依次是:d、c、b、a,则第四周期的Se对应的是b。
(4)Al作阳极失去电子生成Al3+,Al3++3HCO3-==Al(OH)3+3CO2,2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
2.(2010江苏卷)水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为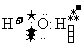
B.4℃时,纯水的pH=7
C.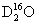 中,质量数之和是质子数之和的两倍
中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离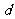 :
: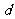 (气态)>
(气态)>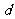 (液态)>
(液态)>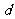 (固态)
(固态)
[答案]C
[解析]本题主要考查的是有关水的化学基本用语。A项,水是共价化合物,其分子的电子式为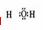 ;B项,温度升高,水的电离程度增大,
;B项,温度升高,水的电离程度增大, C项,一个
C项,一个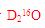 分子中,其质量数为20,质子数为10,D项,在温度压强一定时,它只能呈一种状态。综上分析可知,本题选C项
分子中,其质量数为20,质子数为10,D项,在温度压强一定时,它只能呈一种状态。综上分析可知,本题选C项
5.(2010上海卷)下列判断正确的是
A.酸酐一定是氧化物 B.晶体中一定存在化学键
C.碱性氧化物一定是金属氧化物 D.正四面体分子中键角一定是109o28′
答案:C
解析:此题考查了物质的分类、晶体的构造和分子的构型等知识点。酸酐中大多数是氧化物,但是醋酸酐(C4H6O3)就不是氧化物,A错;惰性气体都是单原子分子,其晶体中只存在分子间作用力,不存在化学键,B错;正四面体分子中,白磷分子的键角是60o,D错。
易混辨析:在化学学习中,有些化学概念极易混淆,比如氧化物和含氧化合物就不完全相同:氧化物由两种元素组成其中一种是氧元素,而含氧化合物只要组成中有氧元素即可,像醋酸酐是含氧化合物就不是氧化物。
2.(2010上海卷)下列有关物质结构的表述正确的是
A.次氯酸的电子式  B.二氧化硅的分子式 SiO2
B.二氧化硅的分子式 SiO2
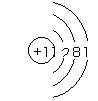 C.硫原子的最外层电子排布式3s23p4
C.硫原子的最外层电子排布式3s23p4
D.钠离子的结构示意图
答案:C
解析:此题考查了物质结构中的原子的核外电子排布、原子结构的表示、化学键、物质的构成等知识点。次氯酸的电子式为: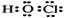 ,A错;二氧化硅是原子晶体,其结构中不存在分子,B错;S是16号元素,其核外电子排布为:1s22s22p63s23p4,C对;钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为:
,A错;二氧化硅是原子晶体,其结构中不存在分子,B错;S是16号元素,其核外电子排布为:1s22s22p63s23p4,C对;钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为: ,D错。
,D错。
技巧点拨:在分析电子排布式的对错时,可以首先写出相应的电子排布式一一对照,得出答案;也可以依次验证电子数目的正误、填充顺序的正误、填充电子数的正误进行判断。
13.(2010山东卷)下列推断正确的是
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、 NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
解析:酸性氧化物能够跟碱反应,生成盐和水的氧化物,故A正确,因为 ,
, 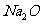 与
与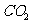 反应生成
反应生成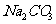 ,
, 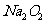 与
与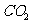 反应除生成
反应除生成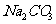 外,还生成
外,还生成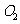 ,故B错;
,故B错;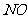 在空气中会发生反应
在空气中会发生反应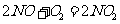 ,故C错;因为新制氯水中含有
,故C错;因为新制氯水中含有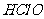 ,故滴入少量的紫色石蕊的现象是先变红,后褪色,故D错。
,故滴入少量的紫色石蕊的现象是先变红,后褪色,故D错。
答案:A
6.(2010全国1)下列判断错误的是
A.沸点: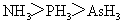 B.熔点:
B.熔点: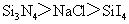
C.酸性: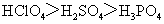 C.碱性:
C.碱性: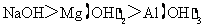
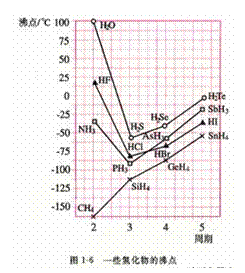 [解析]B考查不同类型晶体的熔沸点高低,2008年高考全国卷I第8题已经考过,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确; C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,2009年高考全国卷I第29题已经考过,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高故应该为:NH3>AsH3>PH3;
[解析]B考查不同类型晶体的熔沸点高低,2008年高考全国卷I第8题已经考过,一般认为是:原子晶体>离子晶体>分子晶体,所以B正确; C项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;D正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。A项错误,2009年高考全国卷I第29题已经考过,NH3分子间存在氢键,故最高,AsH3、PH3分子间不存在氢键,只有范德华力,组成和结构相似的分子相对分子质量越大,其分子间作用力越大,熔沸点越高故应该为:NH3>AsH3>PH3;
[答案]A
[命题意图]考查基本概念:如晶体熔沸点高低判断,氢键与范德华力对物质的物性的影响,金属性、非金属性的强弱判断方法具体应用,这些都是平时反复训练的,这道题目实属原题,属于送分题!
[点评]其实还可以拓展:考同种类型晶体的熔沸点高低判断里面的如同为原子晶体或同为离子晶体等,不应该老局限于分子晶体,这样显得2010年高考题与08和09没有太大区别
9.(2010山东卷) 和
和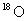 是氧元素的两种核素,
是氧元素的两种核素,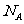 表示阿伏伽德罗常数,下列说法正确的是
表示阿伏伽德罗常数,下列说法正确的是
A.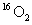 与
与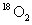 互为同分异构体
互为同分异构体
B.
 与
与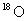 核外电子排布方式不同
核外电子排布方式不同
C.通过化学变化可以实现 与
与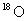 间的相互转化
间的相互转化
D.标准状况下,1.12L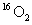 和1.12L
和1.12L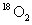 均含有0.1
均含有0.1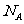 个氧原子
个氧原子
解析:A中的物质是同一种物质,都是氧气,故A错;B中的两种氧原子的电子数相等,核外电子排布也相等,故B错;之间的转化,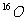 ,
,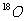 是原子核的变化,不化学变化,故C错;1.12L标准状况下
是原子核的变化,不化学变化,故C错;1.12L标准状况下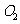 的物质的量为0.05mol,含有氧原子数为0.1
的物质的量为0.05mol,含有氧原子数为0.1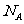 ,故D正确。
,故D正确。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com