
9.(原创)为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是 ( )
|
|
物质 |
杂质 |
试剂 |
主要操作 |
|
A |
乙烷 |
乙烯 |
H2 |
加热 |
|
B |
Na2CO3溶液 |
NaHCO3 |
 |
加热 |
|
C |
Fe |
Al |
氢氧化钠溶液 |
过滤 |
|
D |
乙酸乙酯 |
乙酸 |
氢氧化钠溶液 |
分液 |
解析:在A中无法控制氢气的用量,则A错误;在B中加热小苏打溶液,它不会分解,则B错误;在D中除乙酸能与氢氧化钠溶液反应外,乙酸乙酯也能与氢氧化钠溶液反应。答案:C
命题说明:要求学生掌握常驻见物质的化学性质,会进行简单的分离所需要的试剂和分离的方法。
8.(原创)下列离子方程式正确的是 ( )
A.氢氧化镁与盐酸反应:2OH-+2H+=2H2O
B.碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑
C.过量二氧化硫通入次氯酸钠溶液 SO2+ClO-+H2O=SO42-+Cl-+2H+
D.偏铝酸钠溶液中通入足量二氧化碳 2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32-
解析:氢氧化镁与盐酸反应:Mg(OH) 2+2H+=2H2O+Mg2+;碳酸钙溶于醋酸中:CaCO3+2CH3COOH→Ca2++2CH3COO-+H2O+CO2↑;偏铝酸钠溶液中通入足量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。答案:C
命题说明:要求学生常见物质的溶解性准确掌握,对强弱电解质准确判断,对常见离子和化合物的化学性质灵活应用。
7.(原创)X、Y、Z都是第3周期元素,核电荷数依次增大。X的最高价氧化物对应的水化物是强碱,Z的最高价氧化物对应的水化物是强酸。据此判断下列说法不正确的是 ( )
A.X是第ⅠA元素 B.Z可能是第ⅥA元素或第ⅦA元素
C.X、Y、Z三种元素的最高化合价依次增大
D.X、Z形成的化合物既可以是离子化合物,又可以是共价化合物
解析:X是Na、Z可能是S或Cl,Y 介于X与Z之间,X、Z形成的化合物Na2S或NaCl离子化合物。答案:D
命题说明:要求学生对常见元素在周期表中的位置,常见元素的性质以及化合物的种类有准确理解和判断。
6.(原创)在下列各溶液中,离子可能大量共存的是 ( )
A.无色透明的溶液中:Na+、、Fe3+、NO3-、、Cl-
B.含有大量ClO-的溶液中:K+、H+、I-、SO32-
C.使pH试纸变红的溶液中:NH4+、Cu2+、SO42-、Cl-
D.水电离产生的c(OH-) =10-12mol·L-1的溶液中:Na+、Fe2+、SO42-、NO3-
解析:在A中是黄色溶液;在B中ClO-与溶液中的H+、I-、SO32-皆反应;在D中可能是碱溶液,Fe2+会与氢氧根离子产生沉淀,也可能是酸溶液,Fe2+会与H+、NO3- 反应。答案:C
命题说明:要求学生对不同的介质判断准确,对常见离子的性质要准确理解会应用。
5.(原创)下列实验不能达到的预期目的的是 ( )
①用硝酸钡溶液鉴别硫酸根离子与亚硫根离子 ②用溴水检验汽油中是否含有不饱和脂肪烃
③用乙醇从碘水中萃取碘 ④用盐析方法分离提纯蛋白质
⑤用加热方法提纯含有少量碳酸氢钠的碳酸钠固体 ⑥用氨水清洗试管壁附着的银镜
A.②④⑤ B.①③⑥ C.①②④⑤ D.②③④⑤⑥
解析: ①用硝酸钡溶液不能鉴别硫酸根离子与亚硫根离子,可以用稀盐酸或稀硫酸来鉴别;③用乙醇不能从碘水中萃取碘,可以用苯或四氯化碳来从碘水中萃取碘;⑥不能用氨水清洗试管壁附着的银镜,可以用稀硝酸来清洗试管壁附着的银镜。答案:B
命题说明:要求学生会进行简单离子或相关物质的检验或分离等。
3.(原创)用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.22.4L O2的物质的量约为1mol B.3.4g NH3中含N-H键数目为0.6NA
C.分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g
D.0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1NA
解析:在A中若是在标准状况下,22.4L O2的物质的量约为1mol;在C中若是在标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28g;在D中0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.2NA。答案:B
命题说明:要求学生多视角掌握常见的有关NA的计算。
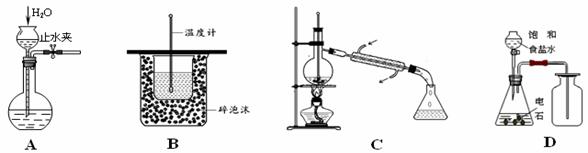 (原创)4.实验是化学研究的基础,下列是在实验室中完成的不同的化学实验,其中能达到实验目的的是 ( )
(原创)4.实验是化学研究的基础,下列是在实验室中完成的不同的化学实验,其中能达到实验目的的是 ( )
A.检验装置的气密性 B.测定中和热
C.除去溴苯中的苯 D.制取并收集乙炔气体
解析:在B中缺少环形玻璃棒;在C中温度计下端插入液面下了;在D中乙炔比空气轻,向上排空气法收集了。答案:A
命题说明:要求学生掌握常见基本实验操作。
2.(原创)下列化学用语正确的是 ( )
A.N2的结构式:N≡N B.乙醇、乙酸和葡萄糖的最简式都为:CH2O
C.甲烷分子的球棍模型: D.S原子的电子排布式:1s22s22p63s23p6
D.S原子的电子排布式:1s22s22p63s23p6
解析:乙酸和葡萄糖的最简式都为:CH2O;在C图是甲烷分子的球棍模型,但碳原子与氢原子体积大小符合事实;S原子的电子排布式:1s22s22p63s23p4。答案:A
命题说明:要求学生掌握有关物质的结构式,有关分子的球棍模型以及有关原子的电子排布式等化学用语。
1.(原创)联合国气候变化大会于2009年12月7-18日在哥本哈根召开。中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。有效“减碳”的手段之一是节能。下列制氢方法最节能的是 ( )
A.电解水制氢:2H2O 2H2↑+O2↑ B.天然气制氢:CH4+H2O
2H2↑+O2↑ B.天然气制氢:CH4+H2O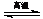 CO+3H2
CO+3H2
C.高温使水分解制氢:2H2O 2H2↑+O2↑ D.太阳光催化分解水制氢:2H2O
2H2↑+O2↑ D.太阳光催化分解水制氢:2H2O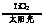 2H2↑+O2↑
2H2↑+O2↑
解析:有效“减碳”的手段之一是节能,利用太阳光催化分解水制氢是最节能的,答案:D
命题说明:让学生密切关注化学与生活,运用化学来改造自然,达到学以致用。
1.今年,我国云南、贵州、广西、重庆、四川五省区旱情形势非常严峻,全国1500万人因旱饮水困难。某源水处理成自来水的工艺流程如下图所示。
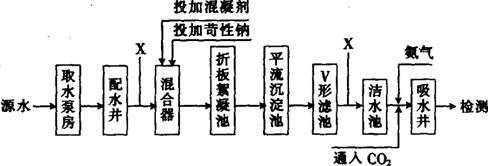
请回答下列问题:
(1)下列有关说法中不正确的是 (填字母)。
A.混合器中加NaOH后,水中 Fe3+、Ca2+、Mg2+ 、HCO3―等可产生Fe(OH)3、CaCO3及Mg(OH)2沉淀
B.向洁水池中通入过量的CO2,则反应的离子方程式为:CO2+2NH3+H2O=2NH4++CO32―
C.高聚合氯化铝铁复合混凝剂,是由铝、铁、羟基、氯元素组成的(其中Fe元素化合价为+3)。若其化学式的平均组成为AlmFe1-x(OH)3-yCly,则m=x
D.滤池中常加石英砂石、活性炭等,其中活性炭可吸附水中的硝基苯等有机毒物
(2)为了给用户提供合格的自来水,使余氯(HOCl、NH2Cl等)和总氯稳定,又要避免盲目投氯以节约成本,所以投氯可一次投氯和多次投氯。下列是某自来水厂在投氯30 min后测定的余氯含量,其中自来水合格且最节省的月份是 (填”6”、“7”或“12”)月份。

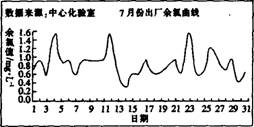
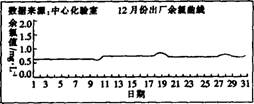
(3)聚合硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。
①实验室配制Fe2(SO4)3溶液时,需在Fe2(SO4)3溶液中加入 (填化学式),目的是 。
②某学生用铁的氧化物为原料来制取聚合硫酸铁。为控制水解时 Fe3+的浓度。防止其生成氢氧化铁沉淀,原料中的 Fe3+必须先还原为Fe2+。实验步骤如下;
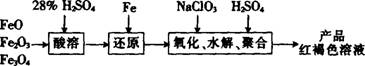
用NaClO3氧化时反应的化学方程式为:6FeSO4+NaClO3+3H2SO4=3Fe2(SO4)3+NaCl。
若改用HNO3氧化,则反应的化学方程式为:6FeSO4+2HNO3+3H2SO4=3Fe2(SO4)3+2NO↑+4H2O。
已知1 mol HNO3价格为0.16元、1 mol NaClO3价格为0.45元,请评价用HNO3代替NaClO3作氧化剂的利弊:利是 ,弊是 。
2、《徐州市2010年高考化学考前预测题》是我市有关高三化学老师辛苦劳动和智慧的结晶,请全市高中化学教师不要将我们的这些资料上传到有关的网站上。如确要上传,也请等到高考之后。谢谢。
徐州市2010年高考化学考前预测题(一)
提供单位 铜山县教研室
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com