
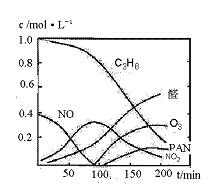
17.(原创)(10分)汽车尾气已经成为大气污染的主要污染源之一,某探究性学习小组的同学在一次社会实践中,到环保部门做了烟雾箱实验,他们起始时投入丙烯、NO及空气,用紫外线长时间照射气体,发生了一系列变化,用物质感应器数据采集器,通过计算机得出如图所示的变化曲线。结合曲线,试回答下列问题。
(1)该烟雾箱实验可模拟下列哪种二次污染产生的机理 。
 a.臭氧层破损坏
b.光化学烟雾
a.臭氧层破损坏
b.光化学烟雾
c.酸雨的形成 d.白色污染
(2)0-100min内,平均反应速率最大的是: (选填:C3H6、NO、NO2、醛、O3、PAN)
(3)已知: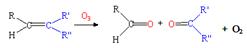 ,写出丙烯与臭氧作用生成醛的化学方程式(并配平) 。
,写出丙烯与臭氧作用生成醛的化学方程式(并配平) 。
(4)消除汽车尾气污染,喷NH3选择性催化还原是常用的一种方法。在950℃时喷NH3与NO反应而脱氮生成氮气,该反应的化学方程式为: 。
(5)2000K时,可以发生如下反应:
 N2+
N2+ O2
O2 NO, K1
NO, K1
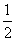 N2+O2
N2+O2 NO2, K2
NO2, K2
4NO 2NO2+N2,该反应的平衡常数K3=
(用K1、K2表示)。
2NO2+N2,该反应的平衡常数K3=
(用K1、K2表示)。
解析: 了解光化学污染原理,根据图形会进行化学反应速率大小的判断,会进行化学平衡常数的换算。
答案:(1)b(2分) (2)NO(2分)(3)CH3CH=CH2+2O3→CH3CHO+HCHO+2O2 (2分)
(4)4NH3+6NO 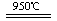 5N2+6H2O(2分)(5)K22/K14(2分)
5N2+6H2O(2分)(5)K22/K14(2分)
提示:(5)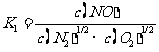 ,
,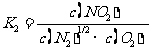
4NO 2NO2+N2,该反应的平衡常数
2NO2+N2,该反应的平衡常数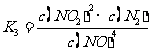 = K22/K14
= K22/K14
命题说明:要求学生认识化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
12.25g 4.5g m
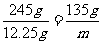 ,m=6.75g
,m=6.75g 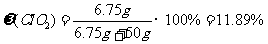
命题说明:要求学生掌握能对探究方案、探究过程、探究结论等进行分析、比较和评价,能准确地表述探究结果,并应用探究结果解决相关问题。
16.(原创)(12分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂,常温下二氧化氯为黄绿色或橘黄色气体,易溶于水,易与碱液反应,其性质非常不稳定,温度过高、二氧化氯的水溶液质量分数高于30%等均有可能引起爆炸。某研究小组设计下图所示实验装置制备ClO2。

现称取12.25gKClO3和9g草酸(H2C2O4)放入烧瓶中,然后再加入足量的稀硫酸,水浴加热。
回答下列问题:
(1)已知反应后的产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为 。
(2)在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60℃-80℃之间。这样操作的目的是 ,图示装置中缺少的一种必须的玻璃仪器是 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 (填序号)。
a.50mL60℃的温水 b.50 mL冰水 c.50 mL饱和食盐水 d.50 mL NaOH溶液
(4)本实验所制得的二氧化氯水溶液质量分数约为 。(小数点后保留两位)
(5)二氧化氯可迅速氧化硫化物,以除去有机硫产生的臭味,改善水产养殖水体的水质。取适量二氧化氯溶液加入到硫化氢溶液中,再向其中加入少量氯化钡溶液,发现有白色沉淀生成。硫化氢溶液与二氧化氯发生反应的离子方程式为 。
解析:在特定的条件下,写出相应的化学方程式和离子方程式,特定条件下实验的灵活处理。
答案:(1)2KClO3+H2C2O4+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O (2)使反应正常进行,控制温度防止温度过高引起爆炸;温度计 (3)b (4)11.89% (5)5H2S+8ClO2+4H2O=5SO42-+8Cl-+18H+
提示:(4)2KClO3 + H2C2O4 + 2H2SO4=2ClO2↑+2CO2↑+2KHSO4+2H2O
245g 90g 135g
0.1000 mol·L-1×24.00×10-3L n 列式解得:n=6×10-3 mol
则有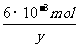 KxFe(C2O4)y·3H2O
KxFe(C2O4)y·3H2O
MnO4- + 5Fe2+ + 8H+=Mn2++5Fe3++4H2O
1mol 5mol
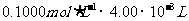
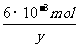 列式解得:y=3,则x=3
列式解得:y=3,则x=3
命题说明:要求学生掌握按照指定路线合成相关物质,结合有关物质的性质以及相关操作进行综合实验和数据处理。
15.(原创)(10分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
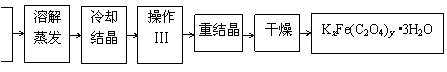 Ⅰ.制备
Ⅰ.制备
K2C2O4
FeCl3
(1)结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:__________________。(2)操作Ⅲ的名称是___________ 。
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。第二次滴定的离子化学方程式为:_______________________________________________________
(3)配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有_______________________________(填仪器名称)。
(4)该化合物KxFe(C2O4)y·3H2O中,x=_______。
解析:在特定的条件下,进行相应的操作,进行多次滴定实验操作。
答案:(1)用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解(2分) (2)过滤、洗涤(2分)
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O(2分) (3)100mL容量瓶、酸式滴定管(2分)(4)3(2分)
提示:2MnO4- + 5H2C2O4 + 6H+=2Mn2++10CO2↑+8H2O
2mol 5mol
14.(原创)T℃时在1L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论正确的是 ( )

A.容器中发生的反应可表示为:3X(g)+Y(g) 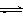 2Z(g)
2Z(g)
B.保持其他条件不变,升高温度,反应的化学平衡常数K减小
C.反应进行的前3 min内,用X表示的反应速率 v(X)=0.1mol/(L·min)
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
解析: 在3min内X、Y和Z的物质的量浓度变化量之比0.6∶0.2∶0.4=3∶1∶2,则A正确;由图2可知:T2 >T1,显然温度升高,平衡向正反应方向移动,则保持其他条件不变,反应的化学平衡常数K增大,B错误;反应进行的前3 min内,用X表示的反应速率 v(X)=0.2mol/(L·min),C错误;D中使用了催化剂缩短反应达到平衡时间。答案:A
命题说明:要求学生掌握根据图象会进行有关物质的反应速率的计算,确定化学反应方程式,进行平衡常数大小的判断,判断外界条件对化学平衡的影响。
第Ⅱ卷(非选择题 共78分)
13.(原创)已知25℃时,MgF2的溶度积常数KSP(MgF2)= 7.42×10-11,CaF2的溶度积常数KSP(CaF2) =1.46×10-10。下列推断合理的是 ( )
A.25℃ 时,CaF2固体在HF溶液中的KSP比在纯水中的KSP小
B.25℃时,饱和MgF2溶液与饱和CaF2溶液相比,前者c(F-)小
C.25℃时,向CaF2悬浊液加入MgCl2溶液后,KSP(CaF2)发生了变化
D.25℃时,向CaF2悬浊液加入MgCl2溶液后,CaF2可能转化为MgF2
解析:只要温度不变,CaF2的溶度积常数KSP不变,则 A、C错;同类型的氟化物,其溶度积常数越大,则氟离子浓度越大,则B正确;25℃时,向CaF2悬浊液中加入MgCl2溶液后,可以转化为溶度积更小的MgF2。答案:CD
命题说明:要求学生掌握溶度积常数的特性、会进行有关溶度积方面的相关判断及计算。
12.(原创)霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物。下列说法正确的是 ( )
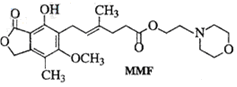 A.MMF能溶于水
A.MMF能溶于水
B.MMF能发生取代反应和消去反应
C.1molMMF能与4mol氢气发生加成反应
D.1molMMF能与含3molNaOH的水溶液完全反应
解析:MMF难溶于水;MMF能发生取代反应。则A、B错误。答案:CD
命题说明:要求学生掌握不同的官能团所具有的化学性质会灵活应用。
11.(原创)下列溶液中有关物质的量浓度关系正确的是 ( )
A.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c (Na+) >c (CH3COO-)>c(H+)>c(OH-)
C.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)

D.在浓度均为0.1 mol·L-1Na2CO3、NaHCO3、C6H5ONa、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c3>c2>c1
解析:以HCO3-、H2O为基准,由质子守恒得:c(OH-)+ c(CO32-)=c(H+)+c(H2CO3),则c(OH-)-c(H+) ==c(H2CO3)-c(CO32-);将B项改为:c(CH3COO-)>c (Na+)>c(H+)>c(OH-);C中是硫酸钠与硫酸铵的混合溶液,铵离子水解溶液呈酸性,则有c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-);D中酸性顺序为:HCl>H2CO3>C6H5OH>HCO3-,则浓度均为0.1 mol·L-1Na2CO3、NaHCO3、C6H5ONa、NH4Cl溶液中c(H+)分别为c1、c2、c3、c4,则c4>c2>c3>c1。答案:AC
命题说明:要求学生掌握在不同的介质中,各离子浓度大小比较,以及有关电荷守恒和物料守恒的应用。
10.(原创)2009年诺贝尔化学奖授予万卡特拉曼-莱马克里斯南等三人,以表彰他们在核糖体的结构和功能方面研究所作出的贡献。核糖体是进行蛋白质合成的重要细胞器,能制造蛋白质。下列关于蛋白质的说法中正确的是 ( )
A.蛋白质分子中只含有C、H、O、N元素
B.只有高温、重金属盐和紫外线才能使蛋白质变性
C.误食重金属盐,可立即喝牛奶或生鸡蛋清进行解毒
D.向蛋白质溶液中加入饱和的(NH4)2SO4溶液,蛋白质会析出,再加水又会溶解
解析:在A中蛋白质分子中只含有C、H、O、N元素,还含有S元素等;B中也可以在酸或碱性条件下蛋白质变性。答案:CD
命题说明:要求学生掌握蛋白质的组成、性质会应用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com