
2.要使产生浑浊和恢复澄清的现象都明显,可将二氧化碳通入饱和石灰水与水的体积比介于_______与_______之间的不饱和石灰水中。
1.以上实验现象表明:假设________(填①/②)是正确的。请通过计算解释上述实验现象。
2. 实验结果记录(如下表)
|
v(石灰水) v(水) |
时间t1 |
现象 |
时间t2 |
现象 |
时间t3 |
现象 |
|
||||||
|
1:0 |
9s |
开始出现浑浊 |
25s |
液体变为乳白色混浊液 |
>2min |
继续吹入CO2,较长时间浊液仍不浑浊 |
|||||||
|
1:1 |
10s |
开始出现浑浊 |
15s |
液体变为乳白色混浊液 |
50s |
继续吹入CO2,浊液变得较澄清 |
|||||||
|
1:2 |
9s |
开始出现浑浊 |
10s |
液体变为乳白色混浊液 |
30s |
继续吹入CO2,浊液变清 |
|||||||
|
1:3 |
10s |
开始出现浑浊 |
16s |
液体变为乳白色混浊液 |
30s |
继续吹入CO2,浊液变清 |
|||||||
|
1:5 |
16s |
出现较多白色颗粒 |
30s |
液体变为较混浊 |
30s |
继续吹入CO2,浊液变清 |
|||||||
|
1:7 |
24s |
出现少量白色颗粒,浑浊不明显 |
/ |
无法判断 |
12s |
继续吹入CO2,浊液变清 |
|||||||
1. 实验操作
(1) 配制饱和石灰水。取适量干燥剂于一次性透明水杯中,加一定量水溶解,用纸巾过滤上层清夜,所得溶液即为澄清的饱和石灰水。(2)配制不同浓度的Ca(OH)2溶液。分别将饱和石灰水稀释2倍、3倍、4倍、6倍、8倍,制得不同浓度的Ca(OH)2溶液。(3)用试管分别取相同体积的上述5种溶液,以正常且尽可能相同的速度向试管中连续不断地吹气泡,同时记录试管中开始出现沉淀所需的时间t1,沉淀完全所需的时间t2以及溶液恢复澄清的时间t3。
药品:干燥剂(旺旺雪饼包装内所用)。仪器:一次性透明塑料水杯、吸管、纸巾、试管。
21.选做题 本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,则以A题得分计入总分。
(原创)21A.(12分)已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的。D原子得到一个电子后3p轨道全充满。A+比D原子形成的离子少一个电子层。C与A形成A2C型离子化合物。E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C、D的第一电离能由小到大的顺序为____________________________。
(2)C的氢化物分子是____________(填“极性”或“非极性”)分子。
(3)化合物BD3的分子空间构型是________________。
(4)E元素原子的核外电子排布式是___________________________;E的一种常见配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂。据此可判断E(CO)5的晶体类型为_____________________;E(CO)5中的配体CO与N2、CN-等互为等电子体,写出CO分子的结构式________________________。
(5)金属E单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。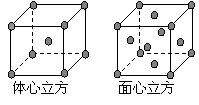 体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为________________________。
体心立方晶胞和面心立方晶胞中实际含有的E原子个数之比为________________________。
解析:A、B、C、D、E分别是Na、P、S、Cl、Fe。
答案:(1)Na<S<P<Cl(1分)(2)极性(1分)(3)三角锥形(2分)
(4)1s22s22p63s23p63d64s2或[Ar]3d64s2(2分) 分子晶体(2分) C≡O(2分) (5)1∶2(2分)
命题说明:要求学生元素在周期表的位置,了解元素第一电离能,了解极性分子和非极性分子,了解常见分子的空间结构,认识原子核外电子的运动状态,了解简单分子的结构式,了解常见晶胞中原子个数之比。
(原创)21B.(12分)滴定法是科研和生产中测定溶液中物质浓度的常用方法。
(1)莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银滴定待测液,进而测定溶液中Cl-的浓度, [Ksp(AgCl) =1.56×10-10,Ksp(Ag2CrO4)=1.10×10-12,Ag2CrO4为砖红色]
①滴定终点的现象是_________________;
②已知该滴定适宜的酸度范围是pH 6.5-10.5,且当溶液中有铵盐存在,c(NH4+)<0.05mol/L时,应将溶液的pH控制在6.5-7.2。下列有关说法你认为合理的有__________。
a.若溶液pH<6.5,则Cr2O72-+H2O 2CrO42-+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
2CrO42-+2H+平衡左移,导致Ag2CrO4沉淀过迟,影响实验结果
b.若溶液中有铵盐存在时,当pH>7.2,则有可能因为生成[Ag(NH3)2]+,影响实验结果
c.滴定时应剧烈摇动,以使被AgCl沉淀吸附的Cl-及时释放出来,防止滴定终点提前
(2)氧化还原滴定是水环境监测常用的方法,可用于测定废水中的化学耗氧量(单位:mg/L--每升水样中还原性物质被氧化需O2的质量)。某废水样100.00mL,用硫酸酸化后,加入0.01667mol/L的K2Cr2O7溶液25.00mL,使水样中的还原性物质在一定条件下完全被氧化。然后用0.1000mol/L的FeSO4标准溶液滴定剩余的Cr2O72-,实验数据记录如下:
 实验数据
实验数据实验序号 |
FeSO4溶液体积读数/mL |
|
|
滴定前 |
滴定后 |
|
|
第一次 |
0.10 |
16.20 |
|
第二次 |
0.30 |
15.31 |
|
第三次 |
0.20 |
15.19 |
①完成离子方程式的配平:
___Cr2O72-+___Fe2++____ _______ ____Cr3++____Fe3++____H2O
②计算废水样的化学耗氧量。 (写出计算过程,结果精确到小数点后一位。)
解析:因为AgCl是白色固体、而Ag2CrO4为砖红色固体,所以用标准硝酸银滴定待测液,当滴入最后一滴标准溶液,生成砖红色沉淀时说明滴定达到终点。
答案:(1)①滴入最后一滴标准溶液,生成砖红色沉淀 (2分)
②abc (3分)
(2)①
 _1__Cr2O72-+_6Fe2++_14
H+ __2Cr3++_6_Fe3++_7H2O (2分)
_1__Cr2O72-+_6Fe2++_14
H+ __2Cr3++_6_Fe3++_7H2O (2分)
② 分析实验数据记录表,第一次实验数据有误,故剔除这一数据。
消耗的FeSO4标准溶液平均体积为:[ (15.31-0.30)+(15.19-0.20)]/2=15.00mL (1分)
则废水中消耗的K2Cr2O7总物质的量为: 0.01667mol/L×0.025L-1/6×15.00×10-3L×0.1000mol/L =1.667×10-4mol=0.1667mmol (2分)
据2K2Cr2O7-3 O2 可知,废水中化学耗氧量
m(O2)= (0.1667mmol×1.5×32g/mol)÷0.1000L=80.0mg/L (2分)
命题说明:要求考生了解对物质进行定性研究和定量分析的基本方法,并初步掌握其操作技能。
29.6t m(H2)×80%
则m(H2)=1.0 t
反应②、③中共需CO14 t、H22.0 t。
C + H2O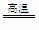 CO
+ H2 CH4
+ H2O
CO
+ H2 CH4
+ H2O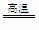 CO
+ 3H2
CO
+ 3H2
12 28 2 16 28 6
m(C) m(CH4)
得方程组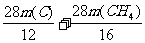 =14
t 和
=14
t 和 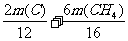 =2.0
t
=2.0
t
解得m(C)=3.0 t m(CH4)=4.0 t
所以需要焦炭3.0 t、甲烷4.0 t
答略 (其它合理答案参照给分)
命题说明:要求学生理解有关的能量的概念,培养让学生根据生产实际会进行计算的能力。
11.2t m(CO)×80% m(H2)×80% m(HOCH2CH2CHO)
则m(CO)=14 t m(H2)=1.0 t m(HOCH2CH2CHO) =29.6 t
反应③中 HOCH2CH2CHO - H2
74 2
19.(原创)(12分)某有机物X的相对分子质量小于100,1mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2112L。
(1)该有机物X的分子式为 。
a.C4H8 b.C2H4O c.C4H8O2 d.C10H20O20
(2)甲物质是X的同分异构体,分子中含羰基和羟基,物质甲能发生如下图所示的转化: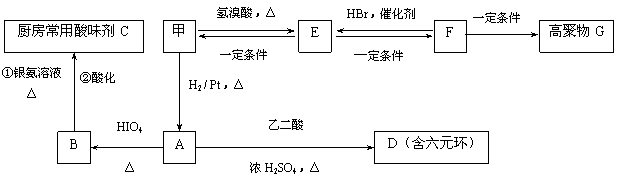
已知: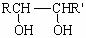
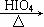 RCHO + R’CHO
RCHO + R’CHO
①B的名称是 。
②A→D的反应类型为 ,E→F的反应条件是 。
③写出F→G的化学方程式: 。
(3)物质乙也是X的同分异构体,1mol乙与足量的Na反应可生成1molH2,且乙不能使溴的CCl4溶液褪色,乙分子中的官能团连在相邻的碳原子上。乙的核磁共振氢谱图中有3个峰,面积比为2∶1∶1。PBS是一种新型生物降解塑料,其结构简式为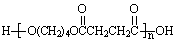 。请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)。
。请设计合理方案以乙为原料(无机试剂自选)合成PBS(用合成路线流程图表示,并注明反应条件)。
提示:①可利用本题(2)中的信息。 ②合成路线流程图示例如下:
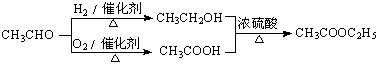
解析:C是CH3COOH、B是CH3CHO、A是CH3CHOHCHOHCH3、甲是CH3COCHOHCH3、E是
CH3COCHBrCH3、F是CH3COCH=CH2。
答案:(1)c (2)①乙醛 ②酯化反应(或取代反应) NaOH醇溶液、加热
③n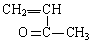

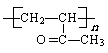
(3)
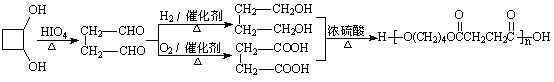
命题说明:要求学生了解烃(烷烃、烯烃、炔烃和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和性质,认识不同类型化合物之间的转化关系,能设计合理路线合成简单有机化合物。
(原创) 20.(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
20.(12分)利用焦炭或天然气制取廉价的CO和H2,再用于氨合成和有机合成是目前工业生产的重要途径。回答下列问题:
(1)甲烷在高温下与水蒸气反应的化学方程式为:CH4+H2O CO+3H2。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1 mol H2O(g)转变为1 mol H2O(l)时放出44.0 kJ热量。写出CH4和水蒸气在高温下反应的热化学方程式 。
(2)1,3―丙二醇是重要的化工原料,用乙烯合成1,3―丙二醇的路线如下:
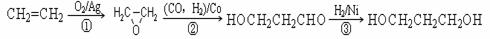
某化工厂已购得乙烯11.2 t,考虑到原料的充分利用,反应②、③所需的CO和H2可由以下两个反应获得:C+H2O CO+H2,CH4+H2O
CO+H2,CH4+H2O CO+3H2,假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
CO+3H2,假设在生产过程中,反应①、②、③中各有机物的转化率均为100%。且反应②中CO和H2、反应③中H2的转化率都为80%,计算至少需要焦炭、甲烷各多少吨,才能满足生产需要?
解析:根据化学反应方程式进行有关热化学方程式的计算,以及相关的化学方程式的计算。
答案:(1)CH4(g)+H2O(g)=CO(g)+3H2 (g); △H =+206.1 kJ·mol-1
提示:(1)CH4(g)+2O2(g)= CO2 (g)+2H2O(l) △H1=-890.3kJ·mol-1
CO(g)+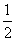 O2(g) =CO2(g)
△H2=-283.0kJ·mol-1
O2(g) =CO2(g)
△H2=-283.0kJ·mol-1
H2(g)+ 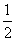 O2(g) =H2O(l) △H3=-285.8 kJ·mol-1
O2(g) =H2O(l) △H3=-285.8 kJ·mol-1
H2O(g)=H2O(l) △H4=-44.0kJ·mol-1
由盖斯定律得: CH4(g)+H2O(g)=CO(g)+3H2 (g);△H =△H1-△H2-3△H3 +△H4
=(-890.3kJ·mol-1)-(-283.0kJ·mol-1 )-3(-285.8 kJ·mol-1)+(-44.0kJ·mol-1)=+206.1 kJ·mol-1
(2)反应②中 C2H4 ~ CO ~ H2 ~ HOCH2CH2CHO
28 28 2 74
18.(原创)(10分)KClO3和KIO3在日常生活、工农业生产和科研方面有着广泛的应用。
(1)实验室可用KClO3分解制取O2,KClO3受热分解的反应分两步进行:①4KClO3(s)=3KClO4(s)+KCl(s);②KClO4(s)=KCl(s)+2O2(g)。已知:
K(s) + 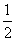 Cl2(g) =
KCl(s) ΔH= -437kJ·mol-1
Cl2(g) =
KCl(s) ΔH= -437kJ·mol-1
K(s) + 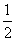 Cl2(g) +
Cl2(g) + 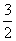 O2(g) = KClO3(s) ΔH= -398kJ·mol-1
O2(g) = KClO3(s) ΔH= -398kJ·mol-1
K(s) +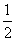 Cl2(g) + 2O2(g)
= KClO4(s) ΔH = -433kJ·mol-1
Cl2(g) + 2O2(g)
= KClO4(s) ΔH = -433kJ·mol-1
则反应4KClO3(s)=3KClO4(s)+KCl(s)的ΔH=____________kJ/mol。
(2)Ca(IO3)2是食品及饲料添加剂补充碘源的优良品种。工业上生产Ca(IO3)2的方法通常有两类:
方法一:氧化剂氧化法。如:用KClO3在盐酸存在条件下,将碘单质氧化为HIO3(KClO3被还原为Cl2),然后加Ca(OH)2中和制得Ca(IO3)2。
方法二:电化学氧化法。用适宜浓度的KOH溶液溶解工业精碘作为阳极液(3I2+6KOH = 5KI+KIO3 +3H2O),用稀KOH溶液为阴极液,电解氧化制备KIO3,与CaCl2反应得到Ca(IO3)2。
①用KClO3氧化碘单质是一剧烈的放热反应,所以要控制加料速度,与电解氧化法相比缺点主要有 。
②电化学氧化法电解时的阳极反应式是 。
③某工厂用电化学氧化法制取Ca(IO3)2,每1kg碘单质理论上可生产纯度为97.8%Ca(IO3)2的质量为 kg(计算结果保留叁位有效数字)。
解析:运用盖斯定律进行相关的计算。运用氧化还原反应原理作准确判断,会进行相应计算处理。
答案:(1)−144kJ/mol(2)①反应剧烈,需要控制速率;反应过程中产生氯气,对生产操作环境有较大污染
②I-+6OH --6e-=IO3-+3H2O (若写成I-+3H2O-6e-=IO3-+6H+不得分) ③1.57kg
提示:(1)则反应4KClO3(s)=3KClO4(s)+KCl(s)的ΔH=4×(+398kJ·mol-1)+3×(-433kJ·mol-1)+ (-437kJ·mol-1)=
−144kJ·mol-1
(2)I2 -
Ca(IO3)2
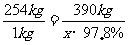
254kg 390kg
1kg x·97.8% x=1.57kg
命题说明:要求学生了解化学能与热能的相互转化及其应用。了解吸热反应、放热反应、反应热(焓变)等概念。能正确书写热化学方程式,能用盖斯定律进行有关反应热的简单计算等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com