
1.溶质的质量分数(ω)
⑴定义:溶质质量分数是溶质的质量和溶液质量的比值,数值上等于100g溶液中含有溶质的质量
⑵公式:
2.阿伏加德罗定律推论:
|
条件 |
结论 |
语言叙述 |
|
T、p相同 |
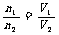 |
同温同压下,气体的分子数与其体积成正比 |
|
T、V相同 |
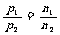 |
温度、体积相同的气体,压强与其分子数成正比 |
|
n、p相同 |
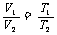 |
分子数相等,压强相同的气体,体积与其温度成正比 |
|
n、T相同 |
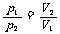 |
分子数相等,温度相同的气体,压强与其体积成反比 |
|
T、p相同 |
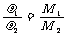 |
同温同压下,气体的密度与其相对分子质量(实际是摩尔质量,下同)成正比 |
|
T、p、V相同 |
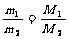 |
同温同压下,体积相同的气体,相对分子质量与其质量成正比 |
|
T、p、m相同 |
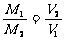 |
同温同压下,等质量的气体,相对分子质量与其体积成反比 |
例5.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
解析:根据阿伏加德罗 定律可知
定律可知 同温同压下气体的密度之比等于摩尔质量之比,即=,由于>1,所以M(甲)>M(乙);由于它们的质量相等,所以甲的物质的量比乙的物质的量少,甲的分子数比乙少;由于它们的外界条件相同,所以它们的摩尔体积相同。
同温同压下气体的密度之比等于摩尔质量之比,即=,由于>1,所以M(甲)>M(乙);由于它们的质量相等,所以甲的物质的量比乙的物质的量少,甲的分子数比乙少;由于它们的外界条件相同,所以它们的摩尔体积相同。
答案:B。
考点四、物质的量浓度与溶质质量分数
1.阿伏加德罗定律:同温、同压下,相同体积的气体具有相同的分子数。即同T、P、V 同n,同N,只要任意三个相同成立就会得出第四个相同。
同n,同N,只要任意三个相同成立就会得出第四个相同。
36.(8分)某校老师让化学实验小组的同学进行有关Na2CO3和NaCl的系列实验.
实验一:鉴别失去标签的Na2CO3溶液和NaCl溶液.
同学们分别选择了下列物质进行实验.其中合理的是 ▲ .
①稀盐酸 ②澄清石灰水 ③pH试纸
实验二:除去某NaCl样品中的少量Na2CO3.
同学们设计了如下实验流程图:
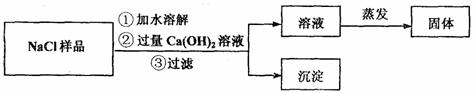
(1)上述流程图中,沉淀的化学式为 ▲ ;
(2)实验完毕后,同学们发现溶液中的溶质除含有NaCl外还含有 ▲ .
于是同学们改用了新的方案:向样品中滴加稀盐酸至不再产生气体为止.有关反应的化学方程式 ▲ .
实验三:完成了上述实验后,同学们又进行了以下的探究活动.
[实验目的]测定该NaCl样品中Na2CO3的质量分数.
[设计方案]根据实验目的和原理,同学们认为需要测得下列四个数据:
①NaCl样品的质量ag; ②充分反应后,生成沉淀的质量为bg;
③反应前装置和药品的质量为cg; ④充分反应后装置和药品的质最为dg.
[实验用品]老师提供了以下实验用品.
药品:足量的稀H2SO4、CaCl2溶液、碱石灰、浓硫酸 装置如下:
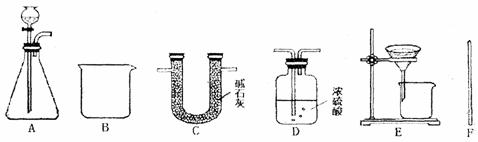
[查阅资料]①CaCl2与Na2CO3两种溶液能发生复分解反应.
②碱石灰是烧碱和氧化钙的固体混合物,主要盟作气体干燥剂.
[实验报告]请你帮助他们完成下表(碱石灰和浓硫酸已被选用,下表中不再填写).
|
方案 |
药品 |
实验 装置 |
所需数据(用ag、bg、cg、dg表示) |
Na2CO3的质量分数计算式 |
|
一 |
|
B、E、F |
|
|
|
二 |
|
|
ag、cg、dg |
|
|
三 |
|
|
|
|
[实验反思]老师为什么提供CaCl2溶液而不是石灰水, ▲ .
35.(7分)(1)现有如图所示的下列实验装置.
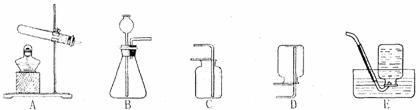
用高锰酸钾制取氧气的化学方程式为 ▲ ,应选用制取装置为 ▲
(填字母代号,下同).实验室制取二氧化碳用 ▲ 装置,发生反应的化学方程式为 ▲ .
(2)下图装置既可用于制取气体,又可用于验证物质的性质.
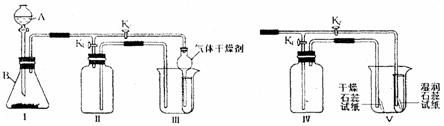
①若A中为双氧水,B中为二氧化锰,用排水法收集一瓶氧气应进行的操作是 ▲ ,
若收集一试管干燥的氧气,应进行的操作是 ▲ .
②若A中为稀盐酸,B中为石灰石,装置Ⅳ中盛1/3瓶浓硫酸,把装置Ⅰ、Ⅳ、Ⅴ相连,可进行的实验是 ▲ .
34.(5分)A、B、C、D、E、F、G为初中化学教材中的常见物质.其中D、F为单质,B
为最常见的溶剂,A、C、G在常温下为气体,A物质是天然气的主要成分.它们之间的转化如下图所示(部分产物未全部列出).
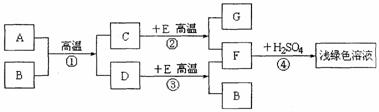
回答下列问题:
(1)写出浅绿色溶液中溶质的化学式 ▲ ;
(2)在①②③④四个反应中,属于置换反应的有 ▲ ;
(3)实验室中检验G物质的化学方程式为 ▲ ;
(4)写出反应①和②的反应方程式:
▲ 、 ▲ .
33.(5分)、小明同学绘制了如图甲所示X、Y、Z三种物质的溶解度曲线,依据图甲、图乙回答下列问题:

(1)当 ▲ ℃时,X物质与Y物质的溶解度相等.
(2)在t1℃时,X、Y、Z三种固体物质的溶解度由大到小的顺序是 ▲ .
(3)我国有许多盐碱湖,湖中溶有大量的NaCl和Na2CO3,那里的人们“冬天捞碱,夏天晒盐”.据此你认为图甲中 ▲ (填字母)曲线与纯碱的溶解度曲线相似.
(4)如图乙所示,20℃时向小烧杯中加入适量的固体物质A,若Z的饱和溶液中有部分
溶质析出,则加入的固体A可能是 ▲ ;将Z的饱和溶液换为X 的饱和溶液,重复
的饱和溶液,重复 上述实验操作,若观察到X的饱和溶液中同样有部分溶质析出,则加入的固体物质A可能是 ▲
.
上述实验操作,若观察到X的饱和溶液中同样有部分溶质析出,则加入的固体物质A可能是 ▲
.
32.(7分)根据题目要求完成下列各小题
(1)实验室用锌和稀硫酸反应制取氢气 ▲ ;
(2)已知碱式碳酸铜的化学式为Cu2(OH) 2CO3,可以把它看作由Cu(OH)2和CuCO3组成的物质.试写出Cu2(OH) 2CO3和稀盐酸反应的方程式(用一个方程式表示) ▲ .
(3)利用碘化银进行人工降雨,其主要原理就是运用了冷凝催化剂机制.利用高炮,将碘化银炮弹发射到高空云团的零度层以上,利用碘化银在高空分解生成银单质和碘单质,形成人工冰核.这些冰核经过水汽凝聚,形成冰晶.冰晶发展到一定的程度,它们将通过零度层下降,之后融化,形成雨滴.另查资料知:碘的元素符号为I,其常见化合价为-1价,碘单质化学式为I2.
①写出碘化银分解的化学方程式 ▲ .
②分析上述人工降雨过程中发生的变化,将其中的物理变化和化学变化各举一例
物理变化 ▲ 化学变化 ▲
③写出另外一种可用于人工降雨的物质名称 ▲
④请你提出一个解决城市用水危机的预防性方案 ▲
31.(8分)化学就在我们身边,它与我们的生活息息相关并能改善我们的生活.请从
A.氧气 B.氮气 C.生石灰 D.维生素C E.明矾 F.尿素
G.熟石灰 H.纯碱 I.天然气 J.硫酸 K.盐酸 L.小苏打
这些物质中选择适当的物质填空(填字母).
(1 )抢救危重病人常用的物质是 ▲ ; (2)用于农作物肥料的物质是 ▲ ;
)抢救危重病人常用的物质是 ▲ ; (2)用于农作物肥料的物质是 ▲ ;
(3)常用作袋装食品干燥剂的是 ▲ ; (4)净化水时可作絮凝剂的是 ▲ ;
(5)人体胃液中含有的酸是 ▲ ; (6)缺乏它会引起坏血病的是 ▲ ;
(7)侯氏联合制碱法中的“碱”是 ▲ ;
(8)我国实施的“西气东输”工程输 送的物质是 ▲ .
送的物质是 ▲ .
30.今有一混合物的水溶液,只可能含有以下离 子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68 g;②笫二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.根据上述实验,以下推测正确的是
子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68 g;②笫二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.根据上述实验,以下推测正确的是
A.一定不存在Ba2+,NH4+可能存在 B.CO32-一定存在
C.Na+一定不存在 D.一定不存在Cl-
非选择题(包括6小题,共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com