
5.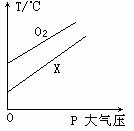 2009年化学竞赛中,某同学进行实验时发现,在体积相等的两个恒容密闭容器中,分别充入等质量的某气体X和O2,测得温度与压强关系如图所示,请你判断下列说话正确的是( )
2009年化学竞赛中,某同学进行实验时发现,在体积相等的两个恒容密闭容器中,分别充入等质量的某气体X和O2,测得温度与压强关系如图所示,请你判断下列说话正确的是( )
A.X可能是HBr气体
B.同温同压同质量时,X气体的体积比O2小
C.X气体的摩尔质量数值一定比乙烷大
D.同温同压下X气体的密度比O2小
[解析]由图像可知,当温度相等时,P(O2) < P(X) ,在同温同体积且同质量的条件下,气体的压强比等于摩尔质量的反比。所以X气体的摩尔质量小于O2,则A、B项错误,D项正确。摩尔质量小于氧气不一定大于乙烷。所以C项也错误。
答案:D
4.用 NA表示阿伏加德罗常数,下列说法正确的是( )
A.1molOH-含有电子数为8NA
B.在标准状况下,22.4L氯气含有原子数为NA
C.在常温常压下,1mol氩气所含原子数为2NA
D.32g铜和足量硫完全反应,生成Cu2S,转移的电子数为0.5 NA
[解析]选项A中1molOH-含有电子数为10NA。选项B中在标准状况下,22.4L氯气含有原子数为2NA。氩气是单原子分子,1mol氩气所含原子数为NA。
答案:D
3. NA为阿伏加德罗常数,则下列说法错误的是( )
A.1mol C2H5OH中一定含有NA个C2H5OH分子
B.将1mol  HCl溶于一定量的水中,所得溶液中的H+的个数为NA
HCl溶于一定量的水中,所得溶液中的H+的个数为NA
C.0.1 mol Na2O2中,阴离子的个数为0.1NA
D.1mol C在氧气中燃烧,转移的电子数一定为4 NA
[解析]碳在氧气中燃烧有两种情况,当氧气不足量时得到的产物为CO,则转移的电子数为2NA,所以D项错误。乙醇属于非电解质,而HCl属于强电解质,所以A、B项正确;Na2O2中含有的是 Na+和O22-,因此也正确。
Na+和O22-,因此也正确。
答案:D
2.下列叙述正确的是( )
A.48gO3气体含有6.02×1023个O3分子
B.常温常压下,4.6 g NO2气体含有1.81×1023个NO2分子
C.0.5 mol·L-1CuCl2溶液中含有3.01×1023个Cu2+
D.标准状况下,33.6 LH2O含有9.03×1023个H2O分子
[解析]B选项4.6gNO2气体中理论上含有1mol NO2分子,约6.02×1023个NO2分子,由于2NO2 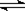 N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
N2O4,故应小于6.02×1023个,具体多少无法计算。C选项中要考虑Cu2+的水解,也无法确定其数目,D选项标准状况下H2O冰水混合物,不能用标准状况下气体摩尔体积22.4L/ mol来计算。
答案:A
1.下列有关物理量相应的单位表达错误的是( )
A.摩尔质量g/mol B.气体摩尔体积L/mol
C.溶解度g/100g D.密度g/cm3
[解析]溶解度的单位为g,不是g/100g 。
答案:C
2.混合
(1)同种溶质不同浓度的两溶液混合计算:
计算依据是 混合前后溶质守恒,即c1V1+c2V2= c3V3(c1、V1 、c2、V2是混合前溶液的浓度和体积,c3、V3是稀释后的浓度和体积。V3= ,当浓度接近时,V3≈V1+V2)。
混合前后溶质守恒,即c1V1+c2V2= c3V3(c1、V1 、c2、V2是混合前溶液的浓度和体积,c3、V3是稀释后的浓度和体积。V3= ,当浓度接近时,V3≈V1+V2)。
例7.已知18.4mol·L-1的硫酸溶液(ρ=1.84g·cm-3)的溶质质量分数为98%。将此浓硫酸缓慢地加入水中,下列结论正确的是( )
A.若水的体积与浓硫酸的体积比为3:1,稀释后溶液的物质的量浓度为4.6mol·L-1
B.若水的体积与浓硫酸的体积比为3:1,稀释后溶液中溶质质量分数为24.5%
C.若水的质量与浓硫酸的质量比为3:1,稀释后溶液的物质的量浓度为4.6mol·L-1
D.若水的质量与浓硫 酸的质量比为3:1,稀释后溶液的溶质质量分数为24.5%
酸的质量比为3:1,稀释后溶液的溶质质量分数为24.5%
 [2010高考预测]化学定量研究离不开计算,定性判断往往也要经过化学计算才能得出结论。因而化学计算是化学体系中不可或缺的重要组成部分。高考化学试卷少不了化学计算题,题解过程需要计算的试题更是超过试卷分值百分之四十。如何成功地进行化学计算总复习是化学教师关心的问题。化学计算能力是化学教学中培养学生的一种能力。化学计算是借助于用数学计算工具,从量的方面来对化学的概念或原理加深理解或通过计算进一步掌握物质的性质及其变化规律,也是依据化学物质的性质与化学规律为载体进行的一种运算能力的训练。另外,通过计算还能培养分析、推理、归纳等逻辑思维能力和解决实际问题的能力。计算的关键是对概念的正确理解,在教学中要加强概念间的联系,认识概念间量的关系,把概念定律联系起来,在讲解化学概念的化学涵义的同时要讲解清楚它的数学涵义,以及建立知识点、线与面之间的关系(建构知识的体系结构)。从认知心理学角度培养学生的逻辑思维能力来看:可以分为两种计算形式具体计算与形式计算。
[2010高考预测]化学定量研究离不开计算,定性判断往往也要经过化学计算才能得出结论。因而化学计算是化学体系中不可或缺的重要组成部分。高考化学试卷少不了化学计算题,题解过程需要计算的试题更是超过试卷分值百分之四十。如何成功地进行化学计算总复习是化学教师关心的问题。化学计算能力是化学教学中培养学生的一种能力。化学计算是借助于用数学计算工具,从量的方面来对化学的概念或原理加深理解或通过计算进一步掌握物质的性质及其变化规律,也是依据化学物质的性质与化学规律为载体进行的一种运算能力的训练。另外,通过计算还能培养分析、推理、归纳等逻辑思维能力和解决实际问题的能力。计算的关键是对概念的正确理解,在教学中要加强概念间的联系,认识概念间量的关系,把概念定律联系起来,在讲解化学概念的化学涵义的同时要讲解清楚它的数学涵义,以及建立知识点、线与面之间的关系(建构知识的体系结构)。从认知心理学角度培养学生的逻辑思维能力来看:可以分为两种计算形式具体计算与形式计算。
测试题
1.稀释
①对于已知质量分数溶液的稀释:
溶质的质量稀释前后不变,即m1·w1=m2·w2(m1、w1是稀释前溶液的质量和质量分数m2、w2是稀释后溶液的质量和质量分数)。
②对于已知物质的量浓度溶液的稀释:
溶质的物质的量稀释前后不变,即c1V1=c2V2(c1、V1是稀释前溶液的浓度和体积,c2、V2是混合后的浓度和体积)。
4.物质的量浓度与溶解度(s)的换算
物质的量浓度与溶解度(s)的换算关系: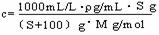
例6、(2009四川)向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是
A.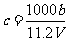 B.
B.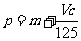 C
C .n=m+17Vc D.
.n=m+17Vc D. 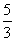 <
< 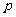 <
<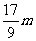
[答案]C
[解析]根据化学方程式可得,生成的氢气的物质的量等于参加反应的碱的物质的量的 考点五、气体溶于水溶液物质的量浓度
考点五、气体溶于水溶液物质的量浓度
在标准状况下,1 L水中溶解某气体V L,所得溶液密度为ρ g·mL-1,已知该气体的摩尔质量为M g·mol-1,水的密度是1 g·mL-1,则溶于水后溶质的物质的量浓度为:c = = =mol·L-1 = mol·L-1
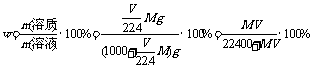
考点六、关于溶液混合与溶液稀释的计算
3.物质的量浓度与质量分数的区别和联系
⑴区别;
|
|
物质的量浓度 |
溶质质量分数 |
|
溶质单位 |
mol |
G |
|
溶液单位 |
L |
g |
|
表达式 |
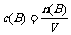 |
 |
|
特点 |
体积相同,物质的量浓度相同的溶液中,所含溶质的物质的量相同,溶质的质量相同 |
质量相同,质量分数相同的溶液中,溶质质量相同,溶质的物质的量相同 |
另外,由于溶液的体积用到的比较多,而且计算反应时用物质的量比质量简单的多,所以物质的量浓度应用更广泛。
⑵物质的量浓度与溶液中溶质的质量分数的换算关系
物质的量浓度c(B)= (上式中密度的单位为g·mL-1,摩尔质量的单位为g·mol-1)
(上式中密度的单位为g·mL-1,摩尔质量的单位为g·mol-1)
2.关于溶解度的基本计算
一定条件下的饱和溶液中,存在下列关系式:
⑴溶质质量∶
溶剂质量=S∶100 即=
⑵溶质质量:
饱和 溶液质量=S∶(100 +S) 即=
溶液质量=S∶(100 +S) 即=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com