
15.(12分)如下图所示,把试管放入盛有的饱和石灰水溶液的烧杯中,用铁夹固定好。在试管中放入几片镁条,再滴入10 mL盐酸于试管中。回答下列问题:
[
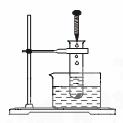
(1)实验中观察到的现象是_______________________________。
(2)产生上述现象的原因是_______________________________。
(3)如果把4.8g镁投入浓度为2.5mol/l 的 200mL稀盐酸中,放出的H2在标准状况下的体积为____。
(4)将生成的H2通过过量的灼热CuO,假设反应完全,则被还原出的铜的质量为__________。
解析:(1)(2)滴入盐酸后发生反应:Mg+2HCl===MgCl2+H2↑,可观察到Mg片逐渐溶解,并有气体产生。该反应放热,使饱和石灰水溶液温度升高。Ca(OH)2的溶解度随温度的升高而减小,因此Ca(OH)2会从溶液中结晶析出。

(1)镁片上有大量气泡产生;镁片逐渐溶解,最后消失;烧杯中溶液内有晶体析出。
(2)镁片和盐酸反应放出H2,并引起镁片的溶解;该反应是放热反应,随着溶液温度的升高,氢氧化钙的溶解度减小,因而从溶液中析出。
(3)4.48L (4) 12.8g
14. 常温下,将NaC1质量分数为14.0%的溶液20.0g与 NaCl质量分数为24.0%的溶液30.0g混合,得到密度为
常温下,将NaC1质量分数为14.0%的溶液20.0g与 NaCl质量分数为24.0%的溶液30.0g混合,得到密度为 的混合溶液,计算:
的混合溶液,计算:
(1)该溶液的物质的量浓度。
(2)在1000g水中需溶入多少molNaCl,才能使其物质的量浓度恰好与上述混合溶液的物质的量浓度相等?
解析:(1)混合溶液中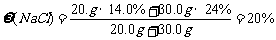
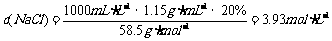
(2)设需溶解xmolNaCl。则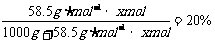 x=4.27mol
x=4.27mol
答案:(1)混合溶液物质的量浓度为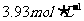 。
。
(2)1000g水中加4.27molNaCl,即可得到与上述混合液浓度相同的溶液。
13、(2010·山东临沂)若NA表示阿佛加德罗常数,下列说法正确的是
A.1 mol Cl2作为氧化剂得到的电子数为NA
B.在0℃,101kPa时,22.4L氢气中含有NA个氢原子
C.14g氮气中含有7NA个电子
D.NA个一氧化碳分子和0.5 mol 甲烷的质量比为7︰4
12.将100g浓度为18mol·L-1、密度为ρg·cm-3的浓硫酸加入到一定量的水中,使之稀释成9mol·L-1的硫酸,则需水的体积为( )
A.小于100mL B.等于100mL
C.大于100mL D.等于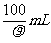
解析:设需水的体积为x,根据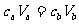 ,则有
,则有
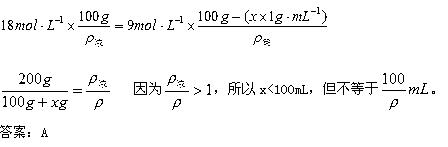
11.相对分子质量为M的某溶质在室温下的溶解度为Sg/100g水,此时测得饱和溶液的密度为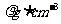 ,则该饱和溶液的物质的量浓度是( )
,则该饱和溶液的物质的量浓度是( )
A.mol·L-1 B.mol·L-1
C. mol·L-1 D.mol·L-1
解析:由物质的量浓度与饱和溶液溶解度的换算关系知:
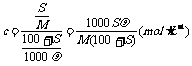
答案:B
10.已知阿伏加德罗常数为NA,下列说法正确的是( )
A.2 mol重水含有NA个D2O分子
B.1 g氢气含有NA个H2分子
C.2 mol钠与过量稀盐酸反应生成NA个H2分子
D.22.4 L水含有NA个H2O分子
解析:2
mol重水含有2NA个D2O分子,1 g氢气是0.5mol,含有0.5NA个H2分子,NA个H原子,根据方程 式:2Na+2H2O=2NaOH+H2↑可知C正确,水是液态不能用摩尔体积。
式:2Na+2H2O=2NaOH+H2↑可知C正确,水是液态不能用摩尔体积。
答案:C
9.同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重114g,该气体的相对分子质量为( )
A.60 B.44 C.32 D. 28
解析:设容器的质量为m,容器所盛气体的物质的量为n。充满O2、CO2时分别有:m+32n=116、m+44n=122,解得:m=100,n=0.5。设该气体的相对分子质量为M,则有100+0.5M=114,解得:M=28。
答案:D
8. Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )
A.1∶7 B.1∶9 C.1∶5 D.2∶9
解析:假设参加反应的Cu2S的物质的量为xmol,被还原的HNO3的物质的量为y,根据得失电子守恒,有x·(2+8)=×1+×3,解得y=5x;起酸性作用的HNO3的物质的量为z,根据Cu(NO3)2的组成,z=(2x-x)×2=2x。故实际参加反应的Cu2S与HNO3的物质的量之比为x:(y+z)=1:7。
答案:A
7.某固体仅由一种元素组成,其密度为5g·cm-3。用X射线研究该固体得结果表明:在棱长1×10-7cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
A.32 B.65 C.120 D.150
6.在273K和10kPa的条件下,将2.00g氮气、1.40g氮气和1.60g氧气混合,该混合气体的体积是( )
A.6.72L B.7.84L C.10.08L D.13.44L
解析:混合气体的总物质的量为:++=0.6mol,故该混合气体的体积为:0.6mol×22.4L/mol=13.44L。
答案:D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com