
3.探究方案:
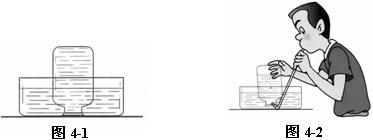
⑴ 取气:先在集气瓶内装满水,用毛玻璃片盖住瓶口,翻转过来,倒扣入水槽中。如图4-1。用弯导管伸入集气瓶内,用嘴向集气瓶内吹气,待有气泡向瓶外冒出时,大水下用毛到点璃片盖住瓶口,取出集气瓶,并正放在桌面上待用,用此法收集两瓶气体。如图4-2所示。由于二氧化碳能溶于水,故此操作要求速度不可太慢。太慢,则二氧化碳溶于水,取出的气体与呼出气体差异较大。
⑶ 验证二氧化碳:取一瓶呼出气体和一个空瓶(里面有空气),分别滴加少量澄清石灰水,稍振荡,观察到呼出气体瓶中石灰水明显变浑浊,而空瓶中石灰水没有明显变化。证明呼出的气体中二氧化碳含量高。如图4-3。
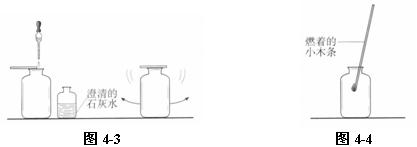
⑶验证氧气:取一瓶呼出气体和一个空瓶,分别伸入一根点燃的小木条,观察燃烧现象。小木条在空气中正常燃烧,在呼出气体中燃烧不旺。证明呼出气体中氧气的浓度低。如图4-4。

⑷ 验证水蒸气:取两块玻璃片,一片置于桌面上,一片对着呼气,观察玻璃表面。对着呼气的玻璃片表面有水雾出现,而置于桌面的玻璃片上无明显变化。如图4-5。
做该实验时,时值高温时节,该实验往往很难观察到现象。教师可引导学生回忆日常生活的经验,如冬天对玻璃呵气,玻璃片上有水雾。也可以将玻璃片稍置于冰箱中冷却一小会(不可时间过长,若玻璃片温度太低,空气中的水蒸气亦可在玻璃片上凝结而出现水雾。)
2.实验仪器:水槽、集气瓶、玻璃管、玻璃片、火柴、小木条。
实验药品:澄清石灰水。
1.化学反应原理
气体经吸入后,在肺部进行气体交换,氧气浓度减小,二氧化碳浓度增加,由于肺部温度较高,水的含量明显高于空气中,甚至达到过饱和状态,故冬天呼吸时有白雾产生。
检验氧气用燃着的木条试验,木条燃烧燃烧不旺,证明氧气浓度降低;二氧化碳用澄清石灰水验证,石灰水变浑浊,证明二氧化碳浓度比空气大;对着冷而干燥的玻璃片呼气,由于水蒸气在玻璃片上液化,玻璃片上出现水滴,由此证明呼出的气体中水的含量高于空气。
6.创新思维:
在实验室制取氧气的实验中,二氧化锰并不是唯一的催化剂。笔者亲自实验过几种不同物质对氯酸钾和过氧化氢溶液的催化效果,又从资料中查阅到,有人也曾做过类似实验,发现有很多物质对过氧化氢和氯酸钾分解都具有催化作用,甚至有的表现出比二氧化锰更好的催化效果。这些物质包括:TiO2、V2O5、Cr2O3、MoO3、P2O5、MnSO4、NaHSO4、Na2S2O4、Ca2P2O7、CuO、Fe2O3、PbO2、ZnO、Al2O3、Al2(SO4)3、CaCl2、KCl、NaCl、CaO、SiO2、碱石灰、细砂子、粉笔灰、碎瓷粉、砖瓦粉、玻璃粉、粘土、石灰石等。其中Fe2O3、CuO、PbO2等的实际效果,从表面上看,比MnO2的催化效果还要更好些。因此实验若无二氧化锰时,完全可以用以上易得的物质做催化剂。
5. 资源开发:
⑴ 在带凸起的双叉试管中,一边加入约1 g的二氧化锰,试管口稍倾斜向上固定在铁架台上,小心加入5 mL 5%的过氧化氢溶液。如图7-4所示。
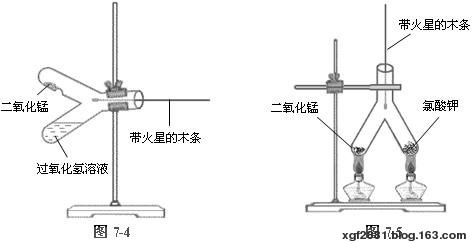
先用带火星的木条试验,木条不复燃,证明无氧气放出。小心扭动又叉试管,使过氧化氢溶液倾入另一管中,再用带火星木条试验,木条立即复燃,并产生明亮的白色火焰。证明有氧气放出。
此实验有明显的反应现象,时间短,用于演示实验效果很好。
⑵ 该反应还可以用二氧化锰催化氯酸钾分解代替。也可以用双叉试管实验。
在双叉试管两边各放入1 g左右的二氧化锰和3 g左右的氯酸钾,固定在铁架台上,用带火星的木条试验。木条不复燃。再分别用两只酒精灯分别在两边加热至氯酸钾熔化,用带火星的木条试验,木条不复燃。如图7-5。
移开酒精灯停止加热,并小心将又叉管倾斜,使二氧化锰倾入氯酸钾中,再用带火星木条试验。木条立即复燃,并产生明亮的白色火焰。证明有氧气迅速放出。
4.探究评价:
该实验先由常温下过氧化氢溶液不能使带火星木条复燃,说明常温下过氧化氢溶液不能放出氧气(准确地说,是放出氧气速率低,不足以使带火星的木条复燃。)再由加热过氧化氢溶液,使带火星木条复燃,说明过氧化氢本身能放出氧气。为讲清催化剂的作用,此实验不能忽视。再从常温下加二氧化锰,有氧气快速放出说明二氧化锰能加速该反应。是该反应的催化剂。
使该实验也存在某些缺点,一是需要的时间比较长,二是没能检测反应后二氧化锰的质量和化学性质不变。
3.探究方案:
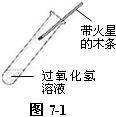
⑴ 在试管中加入约5 mL 5%的过氧化氢溶液,将一根较长的带火星木条伸入试管内试验,木条不复燃,证明无氧气放出。(准确地说,是放出氧气速度慢。)如图7-1。
⑵ 将上述过氧化氢溶液在酒精灯上微加热一会,再用带火星的木条试验,木条复燃。说明加热可加速过氧化氢的分解,同时也说明,过氧化氢本身可以分解,以此说明催化剂不能改变反应的方向。如图7-2。
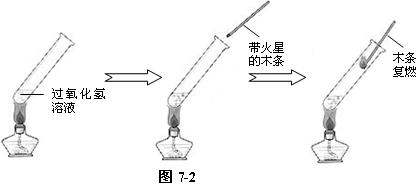
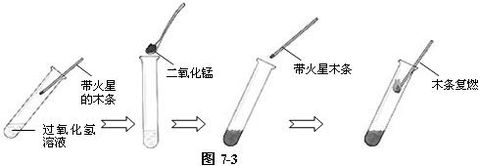
⑶ 另取一支试管,在其中加入约5 mL 5%的过氧化氢溶液,用带火星的木条试验不复燃后,立即加入少量的二氧化锰粉末。再用带火星的木条试验,木条复燃。证明二氧化能加速过氧化氢的分解速率。如图7-3。
2.实验仪器:试管、酒精灯、药匙(或纸槽)、木条等。
实验药品:5%的过氧化氢溶液、二氧化锰等。
1.化学反应原理:
过氧化氢不稳定,在常温下就能缓慢分解放出氧气。但速度较慢,不易察觉。在过氧化氢溶液中加入适量二氧化锰后,能立即有氧气迅速放出。在此反应中,二氧化锰是催化剂,能加速该反应的发生。
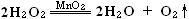
6.创新思维:
⑴ 能否用燃着木条熄灭要验纯二氧化碳?
用排稀酸法收集不同体积的二氧化碳和空气的混合气体,再用燃着的木条试验,测得如下数据。
|
编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
Ⅴ |
|
CO2体积(%) |
80 |
60 |
40 |
20 |
10 |
|
空气体积(%) |
20 |
40 |
60 |
80 |
90 |
|
木条燃烧情况 |
熄灭 |
熄灭 |
熄灭 |
时燃时熄 |
安静燃烧 |
实验证明,只有二氧化碳在空气中的体积分数高于20%时,燃着的木条就会熄灭。可见,用燃着的木条试验二氧化碳的纯度是不可靠的。因此,用排空气法收集二氧化碳并用燃着的木条验纯,不一定能得到较纯的二氧化碳气体。因此,要处到纯净的二氧化碳气体,就应该尽可能用排液体的方法收集。这些方法包括排饱和碳酸氢钠溶液、排稀酸(如在水槽中滴几滴稀盐酸等)溶液等方法。
⑵ 二氧化碳的喷泉实验。
在双孔胶塞上插入一根带止水夹的导管,用滴管吸入一管的新配制的澄清石灰水,插入胶塞内。备用。
用烧瓶收集一瓶二氧化碳气体,立即塞上带导管和胶头滴管的双孔塞。导管插入盛有新配制的澄清石灰水的烧杯中。固定在铁架台上。用手挤压胶头滴管的胶头,将澄清石灰水挤入烧瓶内,打开止水夹。可见到澄清石灰水顺导管逆流入烧瓶内,并形成乳白色的“喷泉”。如图17-9。
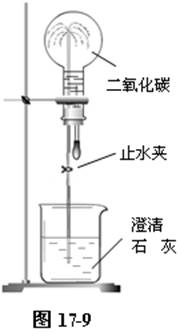
该实验不仅能说明二氧化碳可以与石灰水反应,而且具有很强的视觉冲击力,对于调动学生的学生兴趣很有效果。
⑶ 二氧化碳不能支持燃烧吗?
用坩埚钳夹住一根用砂纸打磨光亮的镁条,在酒精灯火焰上点燃,迅速伸入集满二氧化碳的集气瓶中,镁条继续燃烧,产生耀眼的白光,生成白色固体,同时,在集气瓶壁出现黑色细小的颗粒物。这是由于镁能在点燃条件下,与二氧化碳发生剧烈的反应而燃烧。

可见,说二氧化碳不能燃烧也不支持燃烧,并不是绝对的。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com