
5. 资源开发:
蜡烛是家庭常见的物品,可鼓励学生在家里增加探究项目。
⑴ 探究石蜡的熔点:从蜡烛上切下一块石蜡,投入刚烧开的沸水中,观察到石蜡熔化,说明石蜡的熔点低。
⑵ 探究烛焰焰心部分气体:点燃蜡烛,等蜡烛燃烧较旺时,用镊子夹持一根3-4 cm的玻璃管,伸入烛焰的焰心部位,将焰心部位气体导出,用火柴点燃。如图3-4所示。可看出气体被点燃,说明蜡烛的焰心部位主要由石蜡蒸气组成。
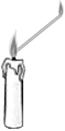
 图3-4 图3-5 |
⑶ 探究烛芯对蜡烛燃烧的影响:在小铁盒中加入适量的石蜡,用火柴点燃,观察点燃的难易程度(一般不易点燃);在石蜡中插入一根棉线(或其他可燃性的条状物,如秸秆、细火柴梗等),再用火柴点燃,观察点燃的难易程度(只要所用烛芯干燥,一般很容易点燃)。
⑷ 探究蜡烛燃烧所生成黑烟的性质:点燃蜡烛,观察烛焰上方产生黑烟。取瓷质碗或碟等置于烛焰上方,一段时间后,瓷片熏黑,取下瓷片,用手捻黑色粉状物,感觉到有滑腻感(如图3-5),这是蜡烛不完全燃烧生成的炭黑。用纸转成纸筒,罩在火焰上,再观察,可见烛焰变亮,黑烟明显减少甚至消失。说明黑烟是石蜡不完全燃烧形成的。
图3-6
4.探究评价:
该探究实验现象比较明显,操作比较简单,探究的深度也比较低,学生容易完成。为激发学生探究积极性,教师可鼓励学生增加探究的内容。
但由于季节问题,做该探究实验时,正值九月,天气炎热,探究有水生成的实验可能现象不明显。可鼓励学生在家里将玻璃片放入冰箱中稍冷却(不可过分冷却,玻璃片温度太低,放在空气中就能导致空气中水蒸气的凝结)。
3.探究方案:
⑴ 点燃前探究:观察蜡烛的外观(包括颜色、状态、形态、组成、结构、硬度、密度等)。
蜡烛由石和棉芯组成;常做成圆柱状;石蜡本身是半透明状的白色,一般的蜡烛因添加了不同颜料而呈不同的颜色,最常见的是本色或红色;可做成不同的形状;硬度小,可用小刀切割;取一小块放入水中,石蜡浮在水层上,说明密度比水小。
⑶ 燃着时探究:点燃蜡烛,观察石蜡的熔化、蜡烛被点燃及燃烧现象,观察火焰的分层情况等。
用燃着的火柴慢慢靠近烛芯,观察蜡烛的熔化到被点燃的过程。
蜡烛火焰的外焰的亮度太低,不易观察。因此,要引导学生认真观察。
用火柴梗平放入烛焰中,火柴梗外侧碳化,说明蜡烛火焰外层(外焰)温度最高(如图3-1)。用冷而干燥的烧杯罩在火焰上方,可观察到烧杯内壁有液滴出现,说明蜡烛燃烧时有水生成(如图3-2);将烧杯迅速翻转,倒入适量的澄清石灰水,振荡,可看到石灰水变浑浊,说明有二氧化碳生成。
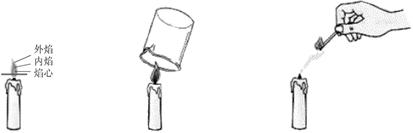
图3-1 图3-2 图3-3
⑶熄灭时探究:吹灭蜡烛,并用火柴点燃刚熄灭时的“白烟”,蜡烛恢复燃烧,说明“白烟”是可燃性气体(其实是石蜡蒸气在空气中凝结成的微小悬浮颗粒)。在做此操作时应注意,点燃的速度要快,稍慢,蜡烛冷却,不再产生蒸气,就很难点燃了;二是,火柴火焰不可离烛芯太远,距离越大,石蜡蒸气浓度越小,越难点燃。(如图3-3)
2.实验仪器:烧杯、玻璃片、火柴。
实验药品:蜡烛、澄清石灰水。
1.化学反应原理
蜡烛由石蜡和绵芯组成,主要反应是石蜡与空气中的氧气发生的氧化反应。石蜡的主要成分是固态烷烃类物质的混合物,其中二十二碳烷和二十八碳烷含量最高。
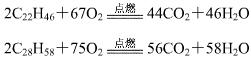
反应过程中,伴随有熔化、放热、发光等现象。
由于石蜡中固态烷烃中碳的质量分数高,在空气中较难充分燃烧,故反应过程中有少量的黑烟生成。

烛焰也分三层,最内层几乎不能接触空气(氧气),没有发生燃烧,故焰心部分基本上由石蜡蒸气组成,颜色很浅,呈浅蓝色;中间部分接触空气(氧气),但接触不充分,产生不完全燃烧,有大量固体的炭粒产生,故温度不太高,但由于固体颗粒受热激发发生较明亮的可见光,因此,内焰部分最明亮,呈明亮的黄色火焰;外层接触空气(氧气)充分,燃烧完全,基本不产生固体颗粒,因此火焰颜色很淡(几乎不易观察到或显较浅的橙红色),但由于燃烧充分,产生的热量多,故温度最高。
6. 创新思维:
该实验的目的是使学生了解试管、胶头滴管等常见仪器的使用方法,探究化学反应中伴随的现象,了解现象是判断变化类型的入门。因此,这一组实验只要现象明显,操作简单均可备选。
日常生活中的很多变化,现象明显、操作简单,应鼓励学生动手开发。如纯碱与醋酸的反应,石灰水与纯碱的反应,铜生锈变成铜绿等。
5. 资源开发:
⑴ 有沉淀生成的化学反应很多,就里就不赘述了。若由学生课外完成,可选用纯碱溶液与石灰水反应,或向澄清石灰水中吹气,均可看到明显的白色浑浊。
⑶ 气体产生的反应,在家庭实验中可选择白醋与干电池中的锌皮反应,铝或铁等均不宜,铝表面的氧化膜使反应速度极慢,铁的活动性和醋酸的酸性都太弱,都很给观察到明显的现象。
⑶ 能量变化的例子很多,不赘述。
⑷ 颜色改变的实验不太多见,以下推荐二例:
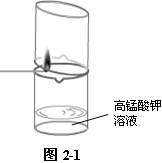
① 火柴燃烧产物使高锰酸钾稀溶液褪色:
如图2-1所示,在烧杯中加入少量稀高锰酸钾溶液(能显示紫色即可,浓度不要太高),用另一个同型烧杯罩在上方,将火柴划燃后,立即伸入烧杯内,一会儿后,抽出火柴梗,盖上烧杯,轻轻振荡,观察。
紫色溶液迅速变成肉黄色(若高锰酸钾溶液浓度小,反应后,溶液颜色接近无色)。
这是由于火柴头内含硫,燃烧后生成二氧化硫:

二氧化硫有还原性,能将高锰酸钾还原成二价锰盐:

高锰酸钾在酸性溶液中氧化性更强,因此,在配制高锰酸钾溶液时,可在其中滴加微量的稀硫酸,反应现象更明显。
⑶ 氯化铁溶液与硫氰化钾溶液反应。
氯化铁溶液显黄色,硫氰化钾溶液无色。在氯化铁溶液中滴入几滴硫氰化钾稀溶液,观察,可见溶液变血红色。
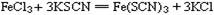
该实验现象很明显,若溶液浓度偏大,反应后溶液颜色太深,视觉效果呈黑色。
4.探究评价:
该实验的目的,一是,了解化学变化中过程中的各种现象;二是,使学生了解滴管、试管等常用仪器的使用方法,初步掌握倾倒液体、滴加液体等基本操作方法。因此,只要现象明显,操作简便的实验均可备选。
3.探究方案:
①在稀氢氧化钠溶液中滴加1-2滴酚酞试液,观察变化。
在氢氧化钠溶液中滴加酚酞试液,在溶液中存在酚酞二钠盐(红色)和酚酞三钠盐(无色),当氢氧化钠溶液浓度较大时,平衡向生成三钠盐方向移动,溶液褪色。因此,要保证溶液不褪色,氢氧化钠溶液的浓度不可过高。
实验证明,只有当NaOH溶液浓度小于0.1mol/L,即溶液pH小于13时,生成的红色酚酞才是稳定的。
但酚酞试液在氨水、氢氧化钙溶液、碳酸钠等溶液中,无论其浓度大小,红色均不褪去,因此,该实验可用这些溶液代替。
②将一段镁条放入试管中,再滴加稀盐酸,观察。有气泡放出,镁条溶解;一会儿后,用手抚摸试管,可感觉到试管壁发烫。
该实验中,镁条可用锌代替,但不宜用铁。铁与稀盐酸(或稀硫酸)反应速率较慢,不易观察到大的气泡,也不易感觉温度的变化,实验现象不明显。若用锌代替镁做该实验,则不宜用稀硫酸,因稀硫酸中的硫酸根离子能阻止金属失去电子成为阳离子,反应一小会儿后,速率明显减慢。若只有稀硫酸时,可以溶液中添加少量的氯化钠溶液。
另外,镁条与稀盐酸反应的速率较慢,特别的盐酸浓度过大时,反应剧烈,常因迅速产生气体,致使液体溅出。因此,稀盐酸的浓度以1∶3为宜。
③在硫酸铜溶液中,滴入氢氧化钠溶液,观察。可见到蓝色絮状沉淀。
做该实验时,氢氧化钠和硫酸钠溶液的浓度均不可太低,滴加溶液后,不要震动,可见明显的蓝色絮状沉淀。笔者在该实验时,曾将试管倒置,试管内液体亦不会流下。
④划燃一根火柴,观察。可见橙黄色火焰,放热。该实验可用其他可燃物燃烧代替。
2.实验仪器:试管、滴管。
实验药品:氢氧化钠溶液、酚酞试液、镁条、稀盐酸、硫酸铜溶液、火柴。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com