
5.资源开发:
⑴ 除二氧化锰上,还有很多物质可用来做该反应的催化剂。这些物质包括:TiO2、V2O5、Cr2O3、MoO3、P2O5、MnSO4、NaHSO4、Na2S2O4、Ca2P2O7、CuO、Fe2O3、PbO2、ZnO、Al2O3、Al2(SO4)3、CaCl2、KCl、NaCl、CaO、SiO2、碱石灰、细砂子、粉笔灰、碎瓷粉、砖瓦粉、玻璃粉、粘土、石灰石等。其中Fe2O3、CuO、PbO2等的实际效果,从表面上看,比MnO2的催化效果还要更好些。
验室若无二氧化锰时,完全可以用以上物质代替。
⑵ 用过氧化氢溶液时,若无二氧化锰,除用以上物质代替外,还可以用高锰酸钾代替,也有理想的放出氧气的速度。
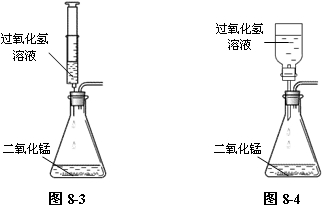
⑶ 用过氧化氢溶液制取氧气时,可以用医用注射器代替分液漏斗,装置如图8-3所示,还可以用塑料瓶代替分液漏斗,装置如图8-4所示。
⑷ 可以不加催化剂而用直接加热过氧化氢溶液的方法制取过氧气。但要注意加热不可过猛,防止产生氧气的速度太快。
4.探究评价:
⑴ 用氯酸钾和二氧化锰混合物制取氧气操作比较简便,产生气体速度适中,易控制反应速度,但由于有副反应,会使收集到的氧气带有白烟,同时有较浓厚的氯气气味。笔者曾用湿润的淀粉碘化钾试纸测试所生成的氧气,试纸变蓝色,说明气体中混有氯气。因此不是实验室制取氧气的最佳选择。
氯酸钾制取氧气最大的缺点是不安全,若氯酸钾中混有可燃性物质,在加热时会发生猛烈爆炸。如:

因此,用氯酸钾和二氧化锰混合加热制取氧气前,一定要对二氧化锰进行事先处理。一般可以将二氧化锰放入坩埚内用酒精喷灯灼烧,若发现二氧化锰中有火星放出,说明其中混有可燃性物质。必须灼烧足够时间,直到无火星放出时为止。
该实验中,二氧化锰加入的量决定了反应的速度,二氧化锰越多,反应速度越快。一般地,教师演示实验,加入的二氧化锰质量约为氯酸钾质量的三分之一为宜,学生实验以五分之一比较好。
⑶ 用高锰酸钾制取氧气,产生气体的速度比较快,且几乎没有副产物,是比较好的制取氧气的方法,但高锰酸钾的粉末颗粒很小,易被气体带入水槽中,故实验时,需要在试管口置一团棉花。
该实验最大的缺点是生成氧气的量比较少,生成的氧气的质量仅占高锰酸钾质量的10%左右,要制取较多的氧气,也不宜用该方法。
⑶用过氧化氢溶液和二氧化锰的混合物制取氧气,很安全,不需加热,生成氧气速度较快。但反应速度不易控制,必须通过控制分液漏斗滴加溶液的速度来控制反应速度,对于初做实验的学生来说,有一定的难度。
为了使反应速度不至于过快,过氧化氢溶液的速度需控制好。教师演示实验时,可控制过氧化氢溶液的浓度在5%-8%之间,学生实验时,必须控制过氧化氢溶液的浓度在3%以下。
3.探究方案:
⑴ 加热高锰酸钾制氧气
①按图8-1所示,将装置连接好。

②检查装置的气密性。若气温较高,用手握方法加热试管的效果很差,几乎看不到导管口有气泡冒出。此时,可用酒精灯微微加热试管,观察导管口是否有气泡放出。再移却酒精灯,静置一会,可观察到水进入导管,在导管里形成一段水柱。证明装置的气密性完好。
③在试管内装入约7 g左右高锰酸钾(用250mL集气瓶收集,可收集到两瓶气体),按要求装好装置:铁夹夹持试管前半端,试管口略向下倾斜;并在试管口部位加一团棉花。
④点燃酒精灯加热,待导管末端气泡均匀放出时,用排水集气法收集气体。加热时,应从前往后慢慢移动酒精灯。若先加热试管后端,气流会将高锰酸钾粉尘冲到导管内。
⑤待气泡从集气瓶口往外冒出时,用水下盖住集气瓶口,移出水面,正放在桌面上待用。
⑥将导管从水槽出取出。
熄灭酒精灯,停止加热。
⑧用带火星木条伸入集气瓶内,木条复燃,证明收集的气体是氧气。
⑶ 用过氧化氢和二氧化锰混合制取氧气。
①按图8-2所示,将装置连接好。
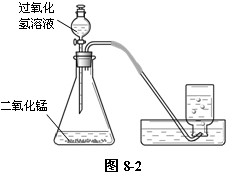
②检查装置的气密性:用止水夹夹住胶皮管,向分液漏斗中注入水,打开分液漏斗活塞,水不会持续流入锥形瓶中,证明装置不漏气。
③在锥形瓶中加入适量的二氧化锰。塞上塞子。
④在分液漏斗中加入过氧化氢溶液,打开塞子,缓慢滴入溶液(根据反应速度确定滴加过氧化氢溶液的速度)。
⑤待气泡均匀且较快放出时,用排水法收集气体。
⑥关闭分液漏斗活塞,从水槽中取出导管。清理实验台。
2.实验仪器:试管、酒精灯、铁架台、带导管的单孔塞、分液漏斗、带导管的双孔塞、水槽、集气瓶、玻璃片。
实验药品:高锰酸钾、二氧化锰、3%过氧化氢溶液。
1.化学反应原理
实验室可利用氯酸钾与二氧化锰混合加热、高锰酸钾加热或过氧化氢溶液和二氧化锰混合制取氧气。

如果实验室缺少MnO2时,可用KMnO4、Fe2O3、CuO等代替MnO2,效果也很不错,而且价格比MnO2低得多。
6. 创新思维:
取一根粗铜丝,将其弯成螺旋状,如图12-8所示。将铜丝放到酒精灯外焰部位加热至红热,使其表面氧化成黑色的氧化铜。

用锥形瓶收集一瓶氢气,把红热的铜丝从酒精灯火焰上取出稍冷,让学生观察到外表的黑色氧化铜后,缓慢伸进集满氢气的锥形瓶口,可见铜丝很快变成紫红色。随即取出,铜丝又被氧化成黑色,再伸进锥形瓶,铜丝又变光亮的紫红色。如此可以反复多次。如图12-9。
5.资源开发:
⑴ 氢气与空气混合爆炸实验可用滴瓶上的滴管代替。如图12-6所示。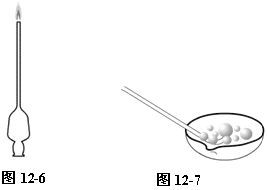
取一根滴瓶上的胶头滴管,去掉胶头,插到氢气发生器导管前的胶皮管上,点燃。立即拔掉胶皮管,手持滴管,尖端朝上,可见氢气仍然继续安静燃烧,随着氢气的消耗,空气进入滴管内,与氢气混合。1-2秒后,听到明显的爆炸声。此实验既可说明纯净的氢气可以在空气中安静燃烧,也可以说明氢气不纯后,遇明火爆炸。
此实验容器小,没有危险性,爆炸声也很响亮。
⑵ 在一个蒸发皿里,加入适量肥皂水,启动氢气发生器,将氢气通入肥皂水中,鼓起氢气泡后,随即向肥皂水中通入适量氧气。迅速用火柴点燃肥皂泡,立即发生尖锐的爆鸣声。如图12-7。
⑶ 取一只塑料方便袋,拎起袋口稍抖动,使袋内盛一定量的空气,将氢气发生器的导管伸入塑料袋内,扎紧袋口,收集氢气,根据袋子膨胀后的体积大小,估计空气与氢气的体积比大约为1∶1时,停止收集气体,取下塑料袋,扎紧袋口。将塑料袋吊悬于某物体上(比如实验室的水管上),用较长的燃着木条点燃塑料袋,可听到猛烈的爆鸣声。
此实验爆炸声音很响,但没有危险。
4.探究评价:
⑴ 用上述方法测定的氢气纯度,不能说明氢气已纯。实验事实证明,只要氢气的纯度超过氢气的爆炸极限,就听不到尖锐的爆鸣声。
下表是不同浓度下氢气点燃时的现象:
|
氢气纯度(%) |
90 |
80 |
70 |
50 |
30 |
10 |
5 |
|
空气体积分数(%) |
10 |
20 |
30 |
50 |
70 |
90 |
95 |
|
点燃现象 |
安静燃烧 |
安静燃烧 |
弱的 爆鸣声 |
强的 爆鸣声 |
强的 爆鸣声 |
弱的 爆鸣声 |
几乎不燃 烧和爆鸣 |
由上表可知,只要氢气的纯度超过70%,点燃时就不会出现爆鸣声。
⑵ 氢气燃烧实验时,气流速度慢了,火焰太小且易熄灭。若在天气较热的夏末秋初做些实验,很难看到有水滴产生,为此,做实验时,可将烧杯稍冷却后再罩在火焰上方。
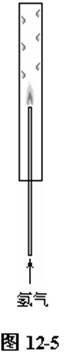
实验中常常看到的是黄色火焰,这是由于玻璃中钠离子的焰色所致。要做好此实验,一是要注意气流不要太小,火焰小了,也很难看到蓝色火焰;二是将玻璃管换成金属管,点燃时可见明显的蓝色火焰。还可以在玻璃导管外套上一支口径为15-20cm的长玻璃管,可见火焰黄色明显减弱,出现蓝色火焰,并明显看到玻璃管壁出现水滴,一段时间后,可见水滴滴下。套上玻璃管,加速了空气对流,使氢气燃烧更加充分。如图12-5。
氢气不纯的爆炸实验,若塑料筒体积较大,爆炸声很响,现象明显,给学生较强烈的刺激。但有一定的危险性,做此实验时一定要注意安全。
⑶ 用氢气还原氧化铜,由于氧化铜粉末颗粒较细,堆积在试管底部,很难与氢气充分接触,完全反应需要较长的时间。为此,可将氧化铜换成加热变黑的铜丝。将粗铜丝弯成螺旋状,在酒精灯上加热烤黑,表面生成薄薄的一层氧化铜,将此螺旋状铜丝置于试管内,通入氢气加热,反应所需要时间短,现象明显。
3.探究方案:
⑴ 检查纯气纯度:用排水集气法收集一试管氢气,用大拇指按住试管口,移进火焰,放开拇指,若听到尖锐的爆鸣声,证明氢气不纯;若听到轻微的“噗”声,说明氢气已纯。如图12-1。
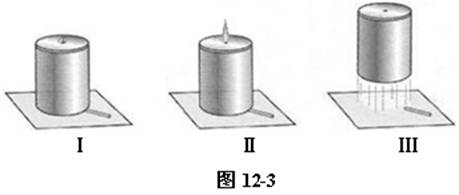
⑵ 点燃在导管口点燃氢气,可观察到蓝色火焰。用冷而干燥的烧杯罩在火焰上方,一会后,可观察到烧杯内壁出现水滴。如图12-2。证明有水生成: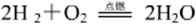 。
。
取一个去盖、底部有小的塑料筒,用纸团堵住小孔,用排水法集满一筒氢气,倒置时筒下垫木条使筒的下边缘一端稍抬起(如图12-3,Ⅰ),拿掉小孔纸团,用燃着的木条在小孔处点火,注意观察有什么现象发生。
可以看到,刚点燃时,氢气安静地燃烧(如图12-3,Ⅱ),过一会儿,随着“砰”的爆炸声响,塑料筒被爆炸的气浪高高掀起(如图12-3,Ⅲ)。
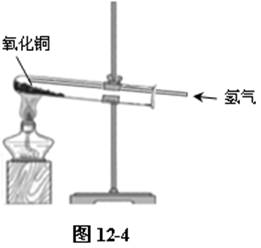
⑶按如图12-4所示装配好装置,先通入氢气,直到排尽试管内空气后,点燃酒精灯加热。防止氢气与空气混合后,遇热爆炸。一会后,可见黑色氧化铜逐渐变光亮的紫红色,试管口有水滴出现。

实验结束后,先停止加热,直到试管冷却后,停止通入氢气。防止铜在较热的条件下氧化成氧化铜,使实验失败。
2.实验仪器:试管、导管、铁架台、酒精灯、塑料筒等
实验药品:贮气瓶中的氢气、氧化铜等。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com