
5. 资源开发:
通过刚才的分析,我们知道,在做好本探究实验除用白磷代替红磷外,就是尽可能防止或减少气体泄漏的可能。我们可以利用以下装置来进行探究:
⑴ 用凸透镜将太阳光聚焦到白磷,使白磷燃烧。此法可以防止燃烧匙伸入集气瓶时气体的散逸。如图5-2。
⑵ 用水浴加热的办法使白磷燃烧,也可以防止燃烧匙伸入集气瓶内气体的散逸。白磷的着火点仅40℃,水温稍高,足以使白磷着火燃烧。如图5-3。做此实验时,盛白磷的广口瓶不能直接放入沸水中,也以免广口瓶因骤热而爆裂。可先用温水淋浴后,再将热水注入外面的大烧杯中。
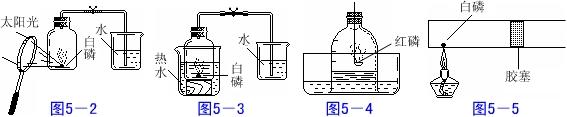
⑶用钟罩代替集气瓶进行实验,如图5-4所示。钟罩下方敞口,气体受热膨胀时,可将水压出一部分从产生减压作用。用此法既减少了气体泄漏的可能,准确性比原实验方案高。
⑷ 在一端封闭的粗玻璃管内放一颗白磷,用胶塞塞住,并使从推入到玻璃管中部,记下位置。用酒精灯微微加热白磷,使之燃烧,同样可观察到白磷燃烧,有大量白烟生成,胶塞被推向外侧(右侧)。待装置冷却,胶塞逐渐向内侧(左侧)移动,根据胶塞停止时的位置,确定空气中氧气的体积。如图5-5。
这种方法在不透气的情况下进行,几乎可以完全防止漏气。但要注意的是,胶塞在干燥条件下很难塞入玻璃管内,可蘸少量水后向管内推入;推入时,还须在胶塞上插一根注射器针头,以便排出气体,待胶塞推到合适位置时,拔出针头即可。
做该实验时,玻璃管不宜太短,太短,加热时胶塞会被推出管外。
4.探究评价:
该探究实验在反应原理上就存在错误。我们都知道,反应物浓度越小,反应的速率越慢。当燃烧持续进行时,氧气的浓度越来越小,氧化的速率也越来越小。一旦燃烧放出的热量不足以维持可燃物在着火点以上温度时,燃烧便停止了。这也是有些物质不能在空气中燃烧,但能在氧气中燃烧的原因。因此,从这个意义上说,利用燃烧试图除尽空气中的氧气,是很难达到目的的。维持红磷燃烧需要的氧气浓度相对较高,因此就更无法除尽氧气了。很多教师在做该实验时,都发现,最终水面停在十分之一处,而不是五分之一处,原因就在于此。
该实验装置可能发生气体泄漏的地方太多,加之燃烧的红磷伸入集气瓶中加热了内部的空气,使之外逸,都会导致实验的误差。
要做好该实验,关键要注意以下几点:
⑴ 用更易燃烧的可燃物代替红磷(如白磷);
⑶ 装置的气密性要好;
⑶ 燃烧匙伸入集气瓶中的速度要快,并塞紧塞子。
3.探究方案:
⑴ 在集气瓶中放入少是水(用于溶解生成的五氧化二磷,同时可吸收燃烧产生的热,有利于瓶内降温),做上记号,并将瓶内剩余体积均分为五等分。
⑶ 用止水夹夹紧乳胶管,点燃燃烧匙内的红磷后,立即伸入集气瓶中并把塞子塞紧。观察到红磷燃烧,产生浓厚的白烟。
⑶红磷熄灭后,冷却至室温,打开止不夹,观察到水进入集气瓶内,最终水面在五分之一记号处。
2.实验仪器:集气瓶、燃烧匙、烧杯、玻璃管、乳胶管、止水夹。
实验药品:红磷、水。
1.化学反应原理
如图5-1所示,利用磷燃烧消耗空气中的氧气,从而使容器内形成负压,打开止水夹后,水进入容器内。进入容器中的水的体积,可粗略地认为是空气中所含氧气的体积。

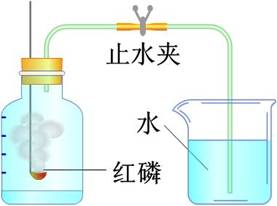 图5-1
图5-1
5.创新思维:
⑴ 能使带火星木星复燃的气体不仅仅是氧气。
① 臭氧(O3)可使带火星的木条复燃。
② 一氧化二氮也能使带火星的木条复燃。一氧化二氮是一种无色气体,加热条件下可以分解生成氮气和氧气。
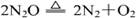
在带火星条件下,加速了分解过程,增强了氧化性,从而使带火星的木条复燃。
③ NO2也能使带火星的木条复燃。这是由于NO2在常温下就能缓慢分解出氧气,在加热条件分解速度更快。因此,带火星的木条在氧气中也能复燃。
⑵ 纯度为多少时,氧气可使带火星的木条复燃?
能使带火星的木条复燃烧的气体,未必是纯净的氧气。让我们看看实验的结果。先在集气瓶内预留一定量的空气,再用排水集气法收集氧气,集满后,用带火星木条试验,结果如下:
|
实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
Ⅴ |
|
集O2体积(%) |
80 |
60 |
40 |
20 |
10 |
|
预留的空气体积(%) |
20 |
40 |
60 |
80 |
90 |
|
带火星木条复燃情况 |
复燃 |
复燃 |
复燃 |
偶有复燃 |
不复燃 |
从实验结果可知,空气中添加20%氧气,带火星的木条就可能复燃,此时混合气体中含氧气:20%+80%×21%=36.8%。该值为视为氧气使带火星的木条复燃的极限。只要混合气体中氧气含量超过此极限值,木条就可能复燃。所以,用带火星木条复燃时,只能说明收集的氧气纯度超过了36.8%这一极限值。
纵上所述,用带火星木条检验排空气法收集的气体是否纯净,是不太可靠的。所以,收集气体(不仅是氧气)时,能用排水法收集气体时,我们仅可能用排水法或用其他排液体的方法收集(如排饱和食盐水、排稀酸溶液等)。
⑶ 木炭燃烧

在试管底部放层细砂,如图6-1所示。
用镊子夹取黄豆大小的一粒木炭,在酒精灯火焰上加热到红热,小心放到试管底的细砂上。通过直角导管向大试管内通入氧气,可看到木炭剧烈燃烧,发出白光。若停止通入氧气,白光消失;继续通入氧气,白光再次出现。该过程可反复多次,直到木炭燃尽为止。
木炭燃尽后,待试管冷却,向大试管中倒入适量的澄清石灰水,振荡,静置。待细砂沉淀后,可见澄清石灰水变浑浊。
⑷ 硫在氧气中燃烧
如图6-2甲所示,取一段约3 cm长的粉笔头,用小刀在其大头一端挖一个小圆坑,将另一端置于燃烧匙上。若难以直立,可以放入粉笔后,滴入熔化的石蜡油,等石蜡凝固后,可将粉笔固定。实验结束后,将燃烧匙浸入热水中,即可取出粉笔。
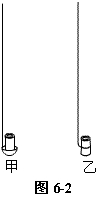
在粉笔坑里放入少量的硫粉,点燃后,将燃烧匙慢慢地插入盛满氧气的集气瓶中,可见硫燃烧更旺,发出明亮的蓝紫色火焰,并有刺激性气味的气体产生。
该实验药品用量少,可避免硫燃烧时与铜质的燃烧匙反应,同时避免末燃烧尽的硫附着在燃烧匙上,难以清洗。
此实验也可不用燃烧匙,而采用如下方法:取一根较长的铁线,下端弯曲将粉笔捆绑住,点燃粉笔圆坑里的硫粉,伸入集气瓶中燃烧。如图6-2乙。
4.探究评价:
该探究实验操作要求比较高,特别是铁丝的燃烧实验,因此一定要求学生掌握实验要领,注意操作的准确性和规范性。为防止炸裂瓶底,放少量水或细砂都有局限性。放水少了起不到吸热作用,水放多了,集气瓶内气体少了。放细砂只能用排空气集气法收集,氧气的纯度很难保证。为避免以上缺点,我们可以在收集之前,在石棉网上剪下一块(比集气瓶内径稍大点),推入集气瓶内,再用排水法收集;亦可以点燃前,将潮湿的多层滤纸放入瓶底,此两法都能比较好的起到隔热作用。
3.探究方案:
⑴ 氧气的检验:用带火星的木条伸入盛氧气的集气瓶中,木条复燃。进行氧气检验时,操作速度不可太慢,因木条易自然熄灭。若改用带火星的卫生香试验效果会更好。若用还火星的木条,易取用木质疏松的杉木、梧桐木等木条,不宜用木质坚硬的材料,火柴梗太短,也不宜使用。
⑶ 用镊子夹持一小块木炭,放在酒精灯上加热,待点燃后移出火焰,观察到木炭红热,无焰,无烟。将此木炭放入盛氧气的集气瓶中,由上往下,慢慢放入,观察到木炭剧烈燃烧,发白光,无烟,无焰。待燃烧结束后,取出木炭,倒入澄清石灰水,稍振荡,观察到澄清石灰水变浑浊。
该实验木炭的宜选用硬质木材烧制的木炭,这样的木炭可保证燃烧的时间比较长,在酒精灯上加热点燃后,移出火焰也不易熄灭。向集气瓶中伸入时,要慢慢地由上往下放入,不宜立即伸入瓶底。木炭燃烧时放热,使气体膨胀而逸出,导致燃烧的时间比较短,观察的时间不长。进行以下实验时,也应比照此操作。
⑶在燃烧匙中先垫一层石棉绒,防止加热时铜与硫反应损坏燃烧匙。再在石棉绒上加入少量硫粉(不可过多)。在酒精灯上加热点燃,移出火焰。观察到硫粉熔化后燃烧,放出微弱的淡蓝色火焰,产生有刺激性气味的气体。将燃烧匙由上往下慢慢伸入集气瓶中,观察到硫粉剧烈燃烧,产生蓝紫色火焰,产生刺激性气味的气体。
为防止产生的二氧化硫污染环境,应在瓶底放少量水,以吸收产生的二氧化硫。反应结束后,若有硫剩余,应立即将燃烧匙伸入水中,使火焰熄灭,尽量减少二氧化硫的污染。
⑷ 在燃烧匙中加入少量红磷,在酒精灯火焰上加热点燃,观察到红磷燃烧,有黄色火焰,产生大量的白烟。立即将燃烧匙伸入盛氧气的集气瓶中,观察到有明亮的白色火焰,产生浓厚的白烟。
产生的五氧化二磷在空气中有刺激性气味,对呼吸道的刺激性较强,因此该实验中红磷的量不宜过多,实验结束后,应立即熄灭红磷。
⑸ 取一根镁条,用砂纸打磨光亮后,用坩埚钳夹住放在酒精灯火焰上点燃,待点燃后,立即移出火焰,放在石棉网上方。观察到镁条剧烈燃烧,产生耀眼的白光,发出大量的热,同时产生白色固体。
镁带打磨光亮,除去表面氧化膜,以避免学生误以为镁是黑色的。做该实验前,一定要提醒学生注意保护眼睛,镁带燃烧时产生的强光对视网膜的刺激性太强,不能直视。
⑹ 取一根细铁丝,弯成螺旋状状(增大铁丝与氧气的接触面积,铁丝燃烧时,给上面的铁丝预热,以利于燃烧持续),在铁丝下端绑一根火柴梗。用坩埚钳夹住铁丝,点燃火柴梗,待火柴梗燃烧接近结束时,将铁丝伸入集气瓶中(同样,由上往下慢慢伸入)。观察到铁丝剧烈燃烧,产生明亮的白光,放热,同时生成黑色固体。
铁丝宜细,但太细易燃烧尽,不利于对现象的观察,一般用石棉网上的铁丝比较合适。若用铁丝窗纱上的细铁丝,可用2-3根拧在一起使用。一定要待火柴梗燃烧将尽时才伸入集气瓶中,过长会消耗更多的氧气,不利于铁丝燃烧。为防止生成的熔融物溅落瓶底,使瓶底炸裂,需在瓶底放少量的水或铺一层细砂。
2.实验仪器:集气瓶、玻璃片、镊子、燃烧匙、石棉网。
实验药品:木条、木炭、硫粉、红磷、镁带、铁丝、石灰水。
1.化学反应原理
氧气是化学性质比较活泼的气体,能和很多物质发生化学反应。碳、硫、磷、镁、铁、蜡烛等物质都可以在氧气中燃烧,放出大量的热,发出明亮的光,同时生成对应的氧化物。
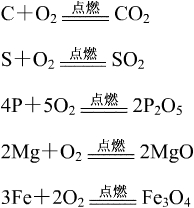
氧气能支持木条燃烧,所以可以用带火星的木条检验氧气。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com