
1.化学反应原理:
⑴ 酸可以和酯碱指示剂作用,不能使无色酚酞试液,使紫色石蕊试液变红色。
⑵ 酸可以和较活泼金属反应,生成盐和氢气。
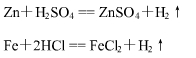
⑶ 酸可以和金属氧化物反应,生成盐和水。

6. 创新思维:
⑴ 当酚酞试液滴入较浓的NaOH溶液(大于2.0 mol/L),立即显紫红色,很快褪成无色;再滴入无色酚酞,又显红色,立即又褪成无色,可以如此反复多次。实验还表明,NaOH溶液的浓度越大,红色褪去的速度越快。
⑵ 把上面实验中滴有酚酞并褪成无色的NaOH溶液分装在几支试管中,做如下实验:
① 加热煮沸,红色又复出现,冷却红色又消失;再加热,再冷却,上述现象不断重复。
② 滴入稀盐酸(或稀硫酸)又出现红色,滴入过量稀盐酸(或稀硫酸)将溶液酸化,红色又消失。
③ 将溶液加水稀释若干倍(10倍以上),再滴入酚酞试液或把稀释液加热煮沸,都会再次显红色。前者说明稀释液仍显碱性,后者说明稀释液在加热时有酚酞生成跟碱反应显红色。
⑶ 把1.0 mol/L NaOH溶液稀释成不同浓度的溶液,再滴入酚酞试液。现象记录如下:
|
NaOH溶液浓度(mol/L) |
1.0 |
0.8 |
0.6 |
0.4 |
0.2 |
0.1 |
0.05 |
|
NaOH溶液体积(mL) |
5 |
5 |
5 |
5 |
5 |
5 |
5 |
|
酚酞试液(滴) |
3 |
3 |
3 |
3 |
3 |
3 |
3 |
|
红色褪去时间(min) |
4-5 |
6-7 |
10-12 |
15-20 |
30-40 |
40-50 |
数小时 |
实验说明,溶液浓度小于0.6 mol/L之后,红色褪去的时间长,褪色也很不彻底(呈粉红色)。
⑷ 在浓氨水、饱和Na2CO3溶液,饱和石灰水,以及浓度小于0.05 mol/L的NaOH溶液中滴入酚酞试液,溶液都呈红色,而且红色均几乎不褪。
酚酞与氢氧化钠溶液反应,其实是酚酞与氢氧化钠生成钠盐的过程。酚酞钠盐有红色二钠盐和无色三钠盐,它们之间存在如下图21-1所示的转化关系:
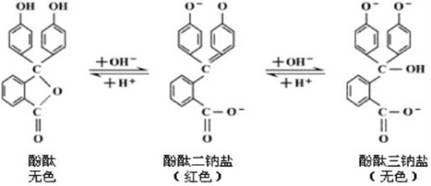
图21-1
酚酞的二钠盐只有在稀碱溶液中才是的,当NaOH溶液浓度大于0.1mol/L或在pH值大于13的强碱性溶液中,这种红色会转化为无色的三价钠盐。
无色三钠盐在水溶液中相当稳定,但与酸反应时又重新生成酚酞二钠盐呈红色。所以在浓碱溶液中滴加酚酞后又变无色的溶液中,滴加酸溶液,一方面酸将碱中和了使碱的浓度降低,同时又使三钠盐转化为二钠盐,溶液再次转化为红色。
有鉴于此,在做指示剂和碱反应的实验时,可以选用任意浓度的氨水或石灰水,也可以用Na2CO3溶液代替,尽可能不要用NaOH、KOH等溶液,也不要用pH>13的碱溶液。
5.资源开发:
⑴ 月季花、菊花、喇叭花、丝瓜花、一串红、牵牛花、凤仙花等浸出液在酸性溶液或碱性溶液里会明显地显示不同的颜色。只要把这些花切碎捣烂,用酒精浸制,所得浸泡液也可以用作酸碱指示剂。
|
植物 |
浸出液颜色 |
遇酸时颜色 |
遇碱时颜色 |
|
白菜叶 |
绿色 |
黄色 |
黄绿色 |
|
月季花 |
土红色 |
桃红色 |
黄色 |
|
红玫瑰 |
红色 |
红色 |
黄色 |
|
牵牛花 |
紫色 |
红色 |
蓝色 |
⑵ 经比较精确的试验,红萝卜皮浸出液、紫卷心菜浸出液和米苋菜浸出液的变色范围如下表。由于浸出液的浓度和制做方法上的差异,其变色范围略有差异。仅供参考:
|
pH |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
|||
|
红萝卜皮浸出液 |
红色 |
紫红色 |
绿色 |
黄色 |
||||||||||||||
|
紫卷心菜浸出液 |
红色 |
浅紫色 |
蓝色 |
青绿色 |
绿色 |
黄色 |
||||||||||||
|
米苋菜浸出液 |
紫红色 |
玫瑰红色 |
洋红色 |
黄色 |
黄绿色 |
亮黄色 |
||||||||||||
⑶ 常见酸、碱指示剂
|
指示剂 |
指示剂本 身性质 |
在酸溶液 中的颜色 |
在碱溶液 中的颜色 |
室温下变色 范围(pH) |
配制方法 |
每10 mL试 液用的滴数 |
|
甲基橙 |
碱 |
红 |
黄 |
3.1-4.4 |
每升水中溶解1 g(0.1%)。 |
1 |
|
石蕊 |
酸 |
红 |
蓝 |
5.0-8.0 |
1g石蕊溶于50mL水中,静置一昼夜后过滤。在滤液中加入30mL95%乙醇,再加水稀释至100mL。 |
3 |
|
酚酞 |
酸 |
无 |
深红 |
8.2-10.0 |
每升90%乙醇中溶解1g。 |
1-3 |
|
百里酚蓝 |
酸 |
红 |
黄 |
1.2-2.8 |
0.1g指示剂溶于4.3mL0.05mol/L NaOH溶液中研匀,用水稀释至 250mL(0.04%);或1g溶液于1L 20%乙醇中。 |
1-2 |
|
甲基黄 |
碱 |
红 |
黄 |
2.3-4.0 |
每升90%乙醇中溶解1 g。 |
1 |
|
溴酚蓝 |
酸 |
黄 |
蓝 |
3.0-4.6 |
0.1g指示剂溶于3mL0.05mol/L NaOH溶液中研匀,用水稀释至250mL;或每升20%乙醇中溶解1g。 |
1 |
|
溴甲酚蓝 |
酸 |
黄 |
蓝 |
3.8-5.4 |
0.1g指示剂溶于3mL0.05mol/L NaOH溶液中研匀,用水稀释至250mL;或每升20%乙醇中溶解1g。 |
1 |
|
甲基红 |
碱 |
红 |
黄 |
4.2-6.3 |
每升60%乙醇中溶解1g。 |
1 |
|
酚红 |
碱 |
黄 |
红 |
6.6-8.9 |
0.1g指示剂溶于5.7mL0.05mol/L NaOH溶液中研匀,用水稀释至250mL。 |
1 |
|
中性红 |
碱 |
红 |
黄橙 |
6.8-8.0 |
每升60%乙醇中溶解1g。 |
1 |
|
百里酚酞 |
酸 |
无 |
蓝 |
9.4-10.6 |
每升90%乙醇中溶解1g。 |
1-2 |
4.探究评价:
本实验的操作很简单,但现象是否明显,在于指示剂的配制。市售的石蕊试剂中含有较多的红色素杂质,若没有除去就配成溶液,将该试液加入碱性溶液中后,由于红色素的干扰,使颜色偏紫,现象不明显。酚酞不溶于水,因此,酚酞试液浓度过大,在溶液中易形成白色浑浊,干扰了实验现象的观察。氢氧化钠溶液浓度过大,滴加酚酞试液后,变红色后会立即变无色,教师在学生面前可能遇到“有理说不清”的尴尬。所以,氢氧化钠溶液的浓度切不可过高,一般在0.1 mol/L以下为宜。
理论上,有色植物器官的浸出液都可以做酸碱指示剂,但有些植物色素在酸碱溶液中变色不明显。教师要多取几种植物色素,通过比较有选择性地推荐给学生。一般来说,在自然条件下颜色较深的植物花瓣、果皮、茎叶表皮等,变色相对比较明显。
3.探究方案:
方案一:
将8支试管分成两组,每组的4组试管中分别加入少量食醋、石灰水、稀盐酸、稀氢氧化钠溶液。向其中一组试管中滴入几滴紫色石蕊试液,向另一组试管中滴入几滴无色酚酞试液。观察现象。
|
|
加入石蕊试液后的颜色 |
加入酚酞试液后的颜色 |
|
食醋 |
红色 |
无色 |
|
石灰水 |
蓝色 |
红色 |
|
稀盐酸 |
红色 |
无色 |
|
稀氢氧化钠溶液 |
蓝色 |
红色 |
以上实验证明石蕊试液遇酸变红色,遇碱变蓝色;酚酞试液遇酸显无色,遇碱显红色。
方案二:
⑴ 取几种植物的有色花瓣或有色表皮,如牵牛花瓣、月季花瓣、紫卷心菜叶、胡萝卜皮等,放入研钵中捣烂,加适量的酒精溶液(乙醇与水的体积比以1∶1为宜)浸泡十分钟。
⑵ 用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
⑶ 将自制的指示剂分别滴加到食醋、石灰水、稀盐酸和稀氢氧化钠溶液中,检测指示剂的变色情况。
2.实验仪器:试管、滴管、研钵、纱布等。
实验药品:石蕊试液、酚酞试液、食醋、石灰水、稀盐酸、稀氢氧化钠溶液、牵牛花、月季花、紫卷心菜、胡萝卜、酒精、蒸馏水等。
1.化学反应原理:
⑴ 石蕊和酚酞等酸碱指示剂能与酸溶液或碱溶液作用,生成不同颜色的物质,因此可用这些物质指示酸或碱,称为酸碱指示剂。其显色情况如下表。
|
指示剂 |
酸性溶液 |
中性溶液 |
碱性溶液 |
|
石蕊 |
红色 |
紫色 |
蓝色 |
|
酚酞 |
无色 |
无色 |
红色 |
⑵ 很多植物色素在酸溶液或碱溶液中也显不同的颜色,也可用于作为酸碱指示剂。
6.创新思维:
⑴ 白磷燃烧验证质量守恒定律的实验,可以按探究实验五相关内容改进。可防止漏气。
⑵ 镁条燃烧后质量怎么变化?
有多位老师告诉笔者,他们的实验结果是:燃烧后生成物质质量比镁的质量增大了。但笔者做了很多次实验,其结果恰好相反--质量减小。
实验时我们发现,镁燃烧时,有大量白烟生成,这些白烟挥发了。连夹持镁条的坩埚钳上都凝结着大量的白色粉末状物质。因此,反应后剩余物质的质量减轻也就不难理解了。做化学实验,不仅要求学生有正确的科学态度,老师也应该有科学的态度。遇到问题,不能绕道走,更不能简单地以为实验失败。要多次实验,从多次实验的结果中找出规律,以求问题的最多解决。
⑶ 碳酸钠与盐酸的反应,可否用于验证质量守恒定律?
教学参考书中指出:“这个实验也可以用固体跟液体反应产生气体的实验代替(例如碳酸钙跟盐酸反应)。反应在吸滤瓶中进行,在抽气口上套一个气球,反应开始后气球膨胀,但天平保持平衡。”
如图13-5所示,在吸滤瓶中加入适量的碳酸钠粉末,在小试管中加入浓盐酸。将小试管放入吸滤瓶中,并用止水夹夹住支管处的橡皮管。整个装置放入托盘天平中,并用砝码平衡,记录读数。取出吸滤瓶,倾斜,使小试管中的盐酸倾倒入瓶中,与碳酸钠粉末反应。可观察到瓶中有大量气泡出现,气球胀大,如图13-6。
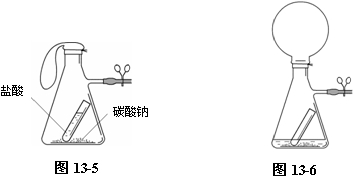
将装置再次放入托盘天平中称量,记录读数。将两次结果相比较。
如此测得的两次数值真的完全相等吗?理论上当然没问题。但我们必须考虑到气球体积增大而产生的浮力,只要气球体积足够大,天平的感量足够灵敏。这种浮力所造成的读数减小是足以表现出来的。初中实验室所用的托盘天平的灵敏度都比较上,一般的感量都在0.2g左右,是无法测出因浮力所造成的读数减小。但我们不能因为测不出来,就以错误的理论出发,再导致错误的结论。
⑷ 能否用蜡烛燃烧验证质量守恒定律?
人教版教学参考书有以下说明:
蜡烛燃烧生成物为二氧化碳和水(气)。碱石灰能有效地吸收这两种物质。这种吸收装置的制作方法如下:
① 截取一段长度为10 cm,直径约为25 mm的玻璃管(可用破了底的大试管截取)。
② 装入金属网栅。从破旧石棉网上剪一块直径略大于玻璃管内径的圆网,从玻璃管的一端轻轻推入,使圆网撑住在离管口约2 cm处作为放置碱石灰的网栅(如网栅容易滑下,可以用回形针改制成一个带有弹性的圆环,弹紧在玻璃管的内壁作为挡圈,使网栅不致滑下),装配如图13-7。

③ 加入碱石灰,制成吸收器。碱石灰要选大的颗粒,使间隙较大,保证气体流通。碱石灰层厚约4 cm-5 cm。
④ 将吸收器固定在天平左盘蜡烛的正上方(如图13-8),即可进行实验。
⑤ 这一实验成败关键在于蜡烛是否正常燃烧,生成的气体是否顺利通过吸收器。所以,蜡烛火焰的大小,吸收器离火焰的距离都要事先试验好。如果实验正常,3 min后即有明显的现象。天平最好选用感量为0.02 g的物理天平。
蜡烛燃烧生成二氧化碳和水(气),参加反应的物质是蜡烛和氧气,生成物是二氧化碳和水。按质量守恒定律可知,参加反应的蜡烛的氧气的质量和等于反应后生成的二氧化碳和水蒸气的质量之和。用上法是无法测也参加反应的氧气的质量的。
依教参的说法,如果天平平衡,那是笔者不好解释的。只能勉强说是未吸收的气体正好等于参加反应的氧气的质量。这种情况存在吗?由于装置复杂,笔者并未做过此实验,不便评说。若天平不平衡,指针一定向左偏转,毫无疑问,这也不能验证质量守恒定律的。
需要指出的是,该实验在老教参中也出现过,教材的编者已经把它当成经典的实验了,但笔者却不敢苟同。
5. 资源开发:
⑴ 该实验可以按排学生当堂实验,学生分组多,证据足,更能说明问题。学生实验可安排一些现象明显、操作简单的。以下推荐几例,仅供参考。

⑵ 质量守恒定律的探究不仅需要安排正例,还需要安排反例。教材中已为我们安排了两个反例。
① 把盛有盐酸的小试管小心地放入装有碳酸钠粉末的小烧杯中,将小烧杯放在托盘天平上用砝码平衡。取下小烧杯并将其倾斜,使小试管中的盐酸与小烧杯中的碳酸钠粉末反应。
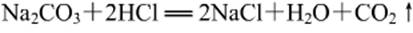
盐酸与碳酸钠粉末迅速反应,有大量气泡产生。一段时间后,再把烧杯放在托盘天平上,观察天平是否平衡。如图13-3。
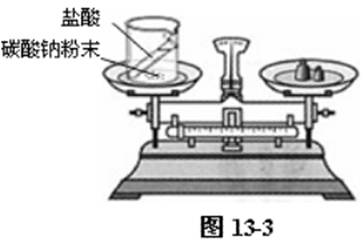
天平不再平衡,这是由于有二氧化碳气体生成逸出的缘故。
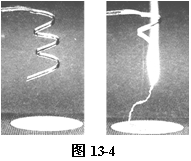
② 取一根用砂纸打磨干净的长镁条和一个石棉网,将它们一起放在托盘天平上称量,记录称得的质量。在石棉网上方将镁条点燃(如图13-4)。
镁条剧烈燃烧,产生耀眼的强光,生成白色固体氧化镁。再将镁条燃烧后的产物和石棉网一起放在托盘天平上称量,记录质量。比较两次称量的质量。
4.探究评价:
实验⑴生成烟状的五氧化二磷,具有一定的代表性,现象也很明显。但由于白磷燃烧时放热,致气体逸出,往往易导致实验的失败。
实验⑵操作简单,实验的成功率很高。但无气体或烟状物质生成,现象不是十分明显,代表性不强。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com