
7.如图所示,光滑绝缘的水平面上M、N两点各放一电荷量分别为+q和+2q,完全相同的金属球A和B,给A和B以大小相等的初动能E0(此时动量大小均为p0)使其相向运动刚好能发生碰撞,碰后返回M、N两点时的动能分别为E1和E2,动量大小分别为p1和p2,则
A.E1=E2=E0 p1=p2=p0
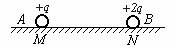 B.E1=E2>E0 p1=p2>p0
B.E1=E2>E0 p1=p2>p0
C.碰撞发生在M、N中点的左侧
D.两球不同时返回M、N两点
6.如图所示,平行的实线代表电场线,方向未知,电荷量为1×10-2C的正电荷在电场中只受电场力作用,该电荷由A点移到B点,动能损失了0.1 J,若A点电势为-10 V,则
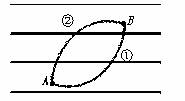 ①B点电势为零
①B点电势为零
②电场线方向向左
③电荷运动的轨迹可能是图中曲线①
④电荷运动的轨迹可能是图中曲线②
A.① B.①② C.①②③ D.①②④
5.AB连线是某电场中的一条电场线,一正电荷从A点处自由释放,电荷仅在电场力作用下沿电场线从A点到B点运动过程中的速度图象如图所示,比较A、B两点电势φ的高低和场强E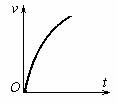 的大小,下列说法中正确的是
的大小,下列说法中正确的是
A.φA>φB,EA>EB
B.φA>φB,EA<EB
C.φA<φB,EA>EB
D.φA<φB,EA<EB
4.如图所示,M、N两点分别放置两个等量种异电荷,A为它们连线的中点,B为连线上靠近N的一点,C为连线中垂线上处于A点上方的一点,在A、B、C三点中
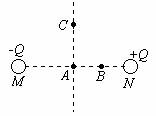 A.场强最小的点是A点,电势最高的点是B点
A.场强最小的点是A点,电势最高的点是B点
B.场强最小的点是A点,电势最高的点是C点
C.场强最小的点是C点,电势最高的点是B点
D.场强最小的点是C点,电势最高的点是A点
3.(2002年上海高考试题)如图所示,在粗糙水平面上固定一点电荷Q,在M点无初速释放一带有恒定电荷量的小物块,小物块在Q的电场中运动到N点静止,则从M点运动到N点的过程中
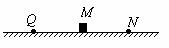 A.小物块所受电场力逐渐减小 B.小物块具有的电势能逐渐减小
A.小物块所受电场力逐渐减小 B.小物块具有的电势能逐渐减小
C.M点的电势一定高于N点的电势
D.小物块电势能变化量的大小一定等于克服摩擦力做的功
2.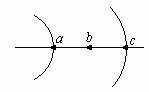 某电场中等势面分布如图所示,图中虚线表示等势面,过a、b两点的等势面电势分别为40 V和10 V,则a、b连线的中点c处的电势应
某电场中等势面分布如图所示,图中虚线表示等势面,过a、b两点的等势面电势分别为40 V和10 V,则a、b连线的中点c处的电势应
A.肯定等于25 V B.大于25 V
C.小于25 V D.可能等于25 V
1.电场中有A、B两点,一个点电荷在A点的电势能为1.2×10-8 J,在B点的电势能为0.80×10-8 J.已知A、B两点在同一条电场线上,如图所示,该点电荷的电荷量为1.0×10-9C,那么
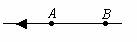 A.该电荷为负电荷
B.该电荷为正电荷
A.该电荷为负电荷
B.该电荷为正电荷
C.A、B两点的电势差UAB=4.0 V
D.把电荷从A移到B,电场力做功为W=4.0 J
原电池原理与电解原理实质都是发生氧化还原反应,相关原理、计算及应用仍符合氧化还原反应规律。物质间的反应大多数是氧化还原反应,氧化还原反应的有关规律及 基本概念在工农业生产、日常生活及科学研究中有非常重要的应用,与很多知识综合皆可构成新颖命题。
基本概念在工农业生产、日常生活及科学研究中有非常重要的应用,与很多知识综合皆可构成新颖命题。
[解题策略]
(1)近几年高考命题的发展趋势,氧化还原反应除主要考查基本概念外,出现了将氧化还原反应方程式的计算与物质的分析推断相综合的趋势。因此解题时,应注重将氧化还原反应的相关化学知识,按内在联系抽象归纳,并 按此规律进行推理和想像。解题过程中,应从分析元素化合价有无变化或升降这一氧化还原反应的特征入手,具体方法是:找变价、判类型、分升降、定其他。关于氧化性或还原性强弱的比较,必须看准题目要求,正确运用氧化性或还原性强弱的比较规律,采用分析比较法解决。对于氧化还原反应的计算,一般采用守恒法解,即依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
按此规律进行推理和想像。解题过程中,应从分析元素化合价有无变化或升降这一氧化还原反应的特征入手,具体方法是:找变价、判类型、分升降、定其他。关于氧化性或还原性强弱的比较,必须看准题目要求,正确运用氧化性或还原性强弱的比较规律,采用分析比较法解决。对于氧化还原反应的计算,一般采用守恒法解,即依据氧化剂得电子总数与还原剂失电子总数相等,列出守恒关系式求解。
(2)近几年高考试题,呈现 出氧化还原反应与STS问题情景相结合,氧化还原反应的计算与物质的分析推断相综合的趋势,以及信息迁移、探讨新问题情景的新型试题。STS教育重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感、态度和价值观等方面的全面发展,它仍是以后高考命题的热点和亮点。今后高考命题会继续涉及上述热点,同时也会因氧化还原反应涉及知识面广,特别是与社会生活知识综合在一起,会有推陈出新的综合性题型出现。
出氧化还原反应与STS问题情景相结合,氧化还原反应的计算与物质的分析推断相综合的趋势,以及信息迁移、探讨新问题情景的新型试题。STS教育重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,以促进学生在知识和技能、过程和方法、情感、态度和价值观等方面的全面发展,它仍是以后高考命题的热点和亮点。今后高考命题会继续涉及上述热点,同时也会因氧化还原反应涉及知识面广,特别是与社会生活知识综合在一起,会有推陈出新的综合性题型出现。
[例1 ]将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2
B.N2O2 C.N2O  D.N2O4
D.N2O4
 [例2 ]
[例2 ] 下列类型的反应,一定发生电子转移的是
下列类型的反应,一定发生电子转移的是
 A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
解析:本题是考查氧化还原反应与四种基本反应类型的关系,考虑问题要注意一些特例。二氧化碳与水化合,碳酸氢铵分解,盐酸与氢氧化钠中和反应,这三个都是非氧化还原反应,没有发生电子转移。A、B、D错误。置换反应中肯定有单质参加,有单质生成,一定属于氧化还原反应,即一定有电子转移,C项正确。答案为C。
[例3]下列叙述正确的是
A.二氧化硫具有还原性,故可作漂白剂
B.钠的金属活性比镁强,故可用钠与氯化镁溶液反应制镁
C.浓硝酸中的硝酸见光分解,故有时在实验室看到的浓硝酸呈黄色
D.Fe在氯气中燃烧生成氯化铁,故在与其他金属反应的产物中的Fe也显+3价
 [例4 ]下列推断合理的是
[例4 ]下列推断合理的是
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
解析:本题主要考查元素化合物的有关性质和氧化还原反应的关系。Al3+能水解生成Al(OH)3胶体,具有较大的表面积,可用作净水剂 ,A正确;金刚石虽然硬度大,但能够与氧气发生氧化还原反应,生成二氧化碳,B错误;浓H2SO4具有
,A正确;金刚石虽然硬度大,但能够与氧气发生氧化还原反应,生成二氧化碳,B错误;浓H2SO4具有 强氧化性可以和Cu在加热条件下发生剧烈反应 ,C错误;将SO2通入品红溶液,溶液褪色,是生成了不稳定的物质,受热分解后又恢复原色。将SO2通入溴水,发生氧化还原反应,溴水褪色后加热不能恢复原色,D错误。答案为A。
强氧化性可以和Cu在加热条件下发生剧烈反应 ,C错误;将SO2通入品红溶液,溶液褪色,是生成了不稳定的物质,受热分解后又恢复原色。将SO2通入溴水,发生氧化还原反应,溴水褪色后加热不能恢复原色,D错误。答案为A。
[例5]物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是 ( )
A. 1:4 B.1:5 C. 2:3 D.2:5
解析:本题审题时注意问的是“该反应中被还原的硝酸与未被还原的硝酸的物质的量之比”。首先写出反应方程式,判断出氧化剂和还原剂,特别注意硝酸只有一部分被还原。4Zn+10HNO3= 4Zn(NO3)2+N2O↑+5H2O。设4molZn参与反应,因Zn无剩余,则最终产物为4molZn(NO3)2,有8mol HNO3没有参与氧化还原反应;根据电子转移守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=2mol,即有2molHNO3被还原。则该反应中被还原的硝酸与未被还原的硝 酸的物质的量之比是1:4 ,答案A正确。
酸的物质的量之比是1:4 ,答案A正确。
[例6]含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2-+Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a, 2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-

 [例7]在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
[例7]在下列变化①大气固氮②硝酸银分解③实验室制取氨气中,按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列,正确的是
 A.①②③ B.②①③ C.③②① D.③①②
A.①②③ B.②①③ C.③②① D.③①②
解析:本题考查了学生对元素及其化合物中知 识的掌握以及对氧化还原反应的理解。大气固氮是将大气中游离态的N转变为N2,N被氧化;硝酸银的分解则是+5价的N价态下降变为N的氧化物,N被还原;实验室中氨气的制备是铵盐与碱共热的复分解反应,N 的价态不变。答案为A。
识的掌握以及对氧化还原反应的理解。大气固氮是将大气中游离态的N转变为N2,N被氧化;硝酸银的分解则是+5价的N价态下降变为N的氧化物,N被还原;实验室中氨气的制备是铵盐与碱共热的复分解反应,N 的价态不变。答案为A。
[例8]常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O;2Fe3++H2O2=2Fe2++O2+H+下列说法正确的是
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
解析 :本题考查氧化还原反应先后顺序。根据氧化还原反应的规律,可知氧化性、还原性的强弱:由2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2的氧化性>Fe3+的氧化性,由2Fe3++H2O2=2Fe2++O2↑+H+,H2O2的还原性>Fe2+的还原性,A错;2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,D对。答案为CD。
:本题考查氧化还原反应先后顺序。根据氧化还原反应的规律,可知氧化性、还原性的强弱:由2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2的氧化性>Fe3+的氧化性,由2Fe3++H2O2=2Fe2++O2↑+H+,H2O2的还原性>Fe2+的还原性,A错;2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,D对。答案为CD。
[例9]过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。
Ⅰ.测定过氧化的含量
请填写下列空白:
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
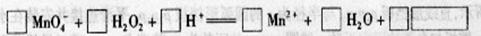
(2) 滴定时,将高锰 酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中。
酸钾标准溶液注入________(填“酸式”或“碱式”)滴定管中。
解析: (1)锰由+7价降低至+2价,氧由-1价升高至0价,得出所缺部分为氧气,根据电子转移守恒,配平化学方程式得:2MnO4- +5H2O2+ 6H+=2Mn2+ +8H2O+ 5O2↑。
(2)由于高锰酸钾标准溶液具有强氧化性,只能使 用玻璃制作的酸式滴定管,不能使用有胶管的碱式滴定管。
用玻璃制作的酸式滴定管,不能使用有胶管的碱式滴定管。
涉及元素的单质及其化合物的许多反应是氧化还原反应,水溶液中进行的绝大多数反应是离子反应,它们是中学化学的重要内容,也是重要的反应类型,两者相互联系、相互渗透,体现了综合应用能力。
氧化还原反应的计算通常会涉及到三大守恒(质量守恒、电荷守恒、电子得失守恒),特别是电子守恒(氧化剂得到电子总数等于还原剂失去电子总数),它是列式求解的关键依据,往往能达到事半功倍、快捷准确的效果。尤其涉及连续、复杂的氧化还原反应计算时,不要按所有情况讨论,也不能按反应一步步进行计算,而是抓住反应的始态和终态各元素中原子的变化情况,利用上面的守恒来计算,使题目变得简单明了。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com