
14.(12分)(2010·徐州模拟)下图甲和乙是某学校王老师制备NH3并进行性质实验时的改 进装置:
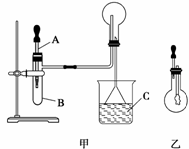
(Ⅰ)按图甲把仪器安装好,称取2 g固体氯化铵装入试管底部,再快速称取2 g氢氧化钠 覆盖在氯化铵上方;立即用带有滴管的塞子塞紧(滴管预先吸入约2 mL浓氨水);烧杯内 盛滴有酚酞试液的水;把浓氨水滴入试管里,可立即观察到试管内发生剧烈反应,有大 量气泡。
(Ⅱ)将(Ⅰ)中收集满NH3的圆底烧瓶取下,改装成图乙所示的装置,胶头滴管内事先预 吸入2 mL H2O,此时小气球系在玻璃棒上呈自然松弛状态;将滴管内的水慢慢滴入烧瓶 中,轻轻晃动烧瓶,通过观察实验现象便可以验证NH3的某个性质。按要求回答下列问 题:
(1)中学化学教材中是用氯化铵与氢氧化钙加热制取NH3,该反应的化学方程式为 ________________________________________________________________________
________________________________________________________________________。
(2)图甲中的NH4Cl与NaOH固体混合能否用CaO固体代替?________(填 “能”或
“不能)。
(3)如何判断图甲中烧瓶已收集满NH3?
________________________________________________________________________
________________________________________________________________________。
(4)乙中胶头滴管中的水挤入烧瓶后,观察到的现象是____________________,它说明了 NH3______________________________________________________________________。
解析 CaO吸水放热,解释同用NaOH固体。
答案 (1)Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O (2)能 (3)烧杯内的溶液变红 (4)气球逐渐变大
极易溶于水
13.(12分)(2008·北京理综,27)X、Y、Z、W为含有相同电子数的分子或离子,均由原 子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+YZ+W
(1)Y的电子式是
________________________________________________________________________。
(2)液态Z与W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式 是________________________________________________________________________。
(3)用图示装置制备NO并验证其还原性。有下列主要操作:
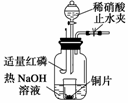
a.向广口瓶内注入足量热NaOH溶液,将盛有铜片的小烧杯放入瓶中。
b.关闭止水夹,点燃红磷,伸入瓶中,塞好胶塞。
c.待红磷充分燃烧,一段时间后打开分液漏斗旋塞,向烧杯中滴入少量稀硝酸。
①步骤c后还缺少的一步主要操作是
________________________________________________________________________。
① 红磷充分燃烧的产物与NaOH溶液反应的离子方程式是
________________________________________________________________________。
② 步骤c滴入稀硝酸后烧杯中的现象是
________________________________________________________________________
________________________________________________________________________。
反应的离子方程式是
________________________________________________________________________。
(4)一定温度下,将1 mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程 中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无 色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关 系如图所示。
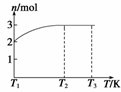
① 温度在T1-T2之间,反应的化学方程式是
________________________________________________________________________
________________________________________________________________________。
 ②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数) 。
②温度在T2-T3之间,气体的平均相对分子质量是(保留1位小数) 。
解析 由题目中X有5个原子核,W为无色液体(H2O)且发生了X+Y
Z+W的 反应可知X为NH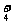 ,Y为OH-,Z为NH3,W为H2O。
,Y为OH-,Z为NH3,W为H2O。
(1)OH-电子式为[??H]-。
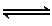 (2)2NH3(1) NH
(2)2NH3(1) NH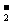 +NH
+NH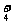
(3)①因实验目的中要求验证NO的还原性,而a、b、c三个步骤只是制NO并没有完成 该目的,故应该打开止水夹,通入少量空气看是否产生红棕色气体。
②因为适量红磷、热NaOH溶液过量,则反应产物为Na3PO4。可以先写化学方程 式:
P2O5+3H2O===2H3PO4 ①
H3PO4+3NaOH===Na3PO4+3H2O ②
合写可得:P2O5+6NaOH===2Na3PO4+3H2O,改写即得。
③气、液、固的三方面变化要答全。
3Cu+8H++2NO===3Cu2++2NO↑+4H2O
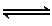 (4)①据题图分析:T1时气体的物质的量为2 mol,则必定是NO2 2 mol,T2时刻气体的物 质的量变为了3 mol,据所学知识只可能发生2NO2 2NO+O2的反应。
(4)①据题图分析:T1时气体的物质的量为2 mol,则必定是NO2 2 mol,T2时刻气体的物 质的量变为了3 mol,据所学知识只可能发生2NO2 2NO+O2的反应。
②T2-T3之间无论反应与否,质量为1 mol N2O4的质量为92 g,物质的量为3 mol,则 平均摩尔质量为M==30.7 g/mol,故平均相对分子质量为30.7。
答案 (1)[??H]- (2)2NH3(l)NH+NH
(3)①打开止水夹,通入少量氧气
②P2O5+6OH-===2PO+3H2O
③Cu片逐渐溶解,有无色气泡冒出,溶液由无色变为蓝色
3Cu+8H++2NO===3Cu2++2NO↑+4H2O
 (4)①2NO2 2NO+O2
(4)①2NO2 2NO+O2
②30.7
12.(2009·盐城中学模拟)同温同压下,在3支相同体积的试管中分别充有等体积混合的 2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水 槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是( )
A.V1>V2>V3 B.V1>V3>V2
C.V2>V3>V1 D.V3>V1>V2
解析 ①NO不与水反应,设原有NO、NO2各3体积,则3体积的NO2与水反应后, 体积变为1体积,此时剩余NO的总体积与原来气体的体积比为4∶6。
②由反应4NO2+O2+2H2O===4HNO3,可知等体积的NO2和O2混合溶于水时O2过量, 若二者皆为4体积则剩余3体积氧气,与原来总体积的比为3∶8。
③N2不与水反应,NH3完全溶于水,气体剩余体积为原来的一半。显然有V1>V3>V2。
答案 B
11.(2010·海淀期末)有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO 气体,其体积在标准状况下为2.24 L。将溶液稀释为1 L,测得溶液的pH=1,此时溶液 中NO的浓度为 ( )
A.0.3 mol/L B.0.4 mol/L
C.0.5 mol/L D.0.6 mol/L
解析 n(NO)==0.1 mol,根据氧化还原反应中转移电子数相等可知:n(Cu、 Zn)==0.15 mol,那么Cu2+、Zn2+对应的NO为0.15 mol×2=0.3 mol,溶液 中NO的浓度为=0.4 mol/L。
答案 B
10.(2010·合肥调研)下列叙述正确的是 ( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO)>c(NH)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1 =10c2
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中增大
解析 A中当pH=7时c(NH)>c(SO),错误;B项中因为醋酸是弱电解质,pH相差1 时浓度相差值大于10倍,错误;C项中醋酸是弱酸,pH相当等体积相混,谁弱谁剩余, 显酸性,故滴入石蕊溶液呈红色,正确;D项中氨水中加入(NH4)2SO4固体抑制NH3·H2O 的电离,故减小。
答案 C
9.(2009·梅县模拟)研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程 如下:
(1)SO2+NO2===SO3+NO
(2)SO3+H2O===H2SO4
(3)2NO+O2===2NO2
NO2在上述过程中的作用与H2SO4在下述变化中的作用相似的是 ( )
①潮湿的氯气 通过盛有浓H2SO4的洗气瓶
②硫化氢通入浓H2SO4中
③浓H2SO4滴入萤石中,加热
④加入少量H2SO4使乙酸乙酯水解
A.①③ B.①④ C.②③ D.②④
解析 由于反应(1)SO2+NO2===SO3+NO (2)SO3+H2O===H2SO4 (3)2NO+ O2===2NO2,可见NO2反应前后没有改变,起催化作用,但从SO2-SO3-H2SO4可见 NO2又起了氧化剂作用。因H2SO4在硫化氢通入浓H2SO4中起氧化剂作用,H2SO4在乙 酸乙酯水解中起催化剂作用,因此答案应选D。
答案 D
8.(2010·杭州质检)从某些性质看,NH3与H2O相当,NH与H3O+相当,NH与OH- 相当,NH2-(有时也包括N3-)与O2-相当。下列有关化学方程式不正确的是( )
A.NH4Cl与KNH2反应:NH4Cl+KNH2===KCl+2NH3↑
B.二价活泼金属M与液氨反应:M+2NH3===M(NH2)2+H2↑
C.盐酸与MNH反应:2HCl+MNH===MCl2+NH3↑
D.NH4Cl与MO反应:2NH4Cl+MO===2HCl+M(NH2)2+H2O
解析 跟NH4Cl+KNH2===KCl+2NH3↑相对应的是
H3OCl+KOH===KCl+2H2O,正确;
跟M+2NH3===M(NH2)2+H2↑相对应的是
M+2H2O===M(OH)2+H2↑,正确;
跟2HCl+MNH===MCl2+NH3↑相对应的是
2HCl+MO===MCl2+H2O,正确;
而2NH4Cl+MO===M(NH2)2+2HCl+H2O和2H3OCl+MO===MCl2+3H2O并不相似。
答案 D
7.(2010·巢湖模拟)三氟化氮(NF3)是无色无味的气体,它可由氨气和氟气反应得到,反 应的化学方程式为4NH3+3F2===NF3+3NH4F。下列有关NF3的叙述不正确的是( )
A.NF3中N呈+3价 B.NF3是共价化合物
C.NF3的氧化性比F2强 D.NF3分子呈三角锥形
解析 NF3的结构与NH3相似,呈三角锥形,是共价化合物。F的非金属性比N强,所 以NF3中N呈+3价。根据题目所给反应知,反应中F2为氧化剂,NF3为氧化产物,所 以NF3的氧化性比F2弱。
答案 C
6.(2010·济宁一模)已知NH3难溶于CCl4,如下图所示,下列装置中,不宜用于吸收氨 气的是 ( )
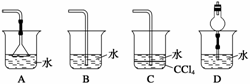
解析 NH3极易溶于水,所以导管直接插入水中吸收NH3时易产生倒吸现象,A项、D 项有效地防止倒吸现象的产生;NH3难溶于CCl4,所以C项也避免了倒吸现象的产生; 而B项易产生倒吸现象,故B项不宜用于NH3的吸收。
答案 B
5.(2010·漳州模拟)顺式Pt(NH3)2Cl2(式量为300)是临床广泛使用的抗肿瘤药物。下列有 关该物质的说法正确的是 ( )
A.由5种元素组成
B.含有NH3分子
C.Pt的化合价为+4
D.Pt元素的质量百分含量为65%
解析 根据分子式和其式量可以推知A错D正确。Pt(NH3)2Cl2分子中不可能包含NH3 分子,在Pt(NH3)2Cl2中Pt应显+2价,B、C错误。
答案 D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com