
15]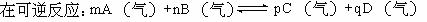
达到平衡后,若反应速率分别用VA,VB,VC,VD表示(单位为mol·L-1·min-1),则正确的关系是
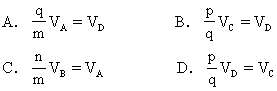
[答案] AD
[解析]在化学反应中,各反应物减小的量和生成物增加的量应和反应方程式中各物质的系数成正比。因此,用各物质表示的化学反应速率也和反应方程式中各物质的系数成正比。
由于比例关系改为乘积关系应是交叉相乘,因此在用速率表示的等式关系中,出现该物质的系数和该物质的反应速率相乘关系,一定是错误的结论。正确的等式关系应是:甲物质的反应速率和乙物质的系数乘积等于乙物质的反应速率和甲物质的系数乘积。
[状元纠错]错解往往是将比例关系视为乘积关系,将各物质的系数和该物质的速率乘积误认为常数,得出选项B,C错误结论。
14]下列事实不能用勒沙特列原理解释的是
A.往H2S溶液中加碱,有利于S2-增多
B.500℃左右比室温更利于氨的合成
C.使用V2O5作催化剂可加快SO2转化为SO3的速率
D.醋酸溶液与锌反应放出H2,加入适量醋酸钠晶体可以减慢放出H2的速率
[正确答案] B,C。
[答案] BC
[解析]勒沙特列原理又称化学平衡移动原理,其研究对象是平衡移动,因此只要涉及平衡移动即可解释。选项C的叙述完全正确,但是它是针对反应速率而言、与该原理毫无关系,不应漏选。选项B中的温度与上一题有类似情况,它受反应速率、催化剂工作温度和平衡移动有关,恰好温度影响又不利平衡移动,因此也不能用勒沙特列原理解释。
[状元纠错]漏选B或C
0.72g·L-1×22.4L·mol-1=16.128g·mol-1;
平均分子量为:16.1,混合气体的物质的量为2.86mol,由此产生一系列的错误结果。
12]已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动时,下列叙述正确的是:①生成物的质量分数一定增加;②生成物产量一定增加;③反应物的转化率一定增大;④反应物的浓度一定降低;⑤正反应速率一定大于逆反应速率;⑥一定使用催化剂A
A.①②③ B.③④⑤ C.②⑤ D.④⑥
[答案] C
[解析]化学平衡向正反应方向移动时,生成物的量一定增加,这是毫无异议的。但是 [13]在673K,1.01×105帕下,有1mol某气体A,发生如下反
[13]在673K,1.01×105帕下,有1mol某气体A,发生如下反
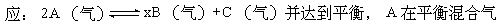
中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数x的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
[答案] (1)39.8;(2)32%;(3)2;(4)1.16
[解析]本题的错误主要产生于对密度的认识。由于达到平衡时,该体系处于非标准状况下,题目给的密度也是非标准状况下的密度,因此不能简单以该密度和气体的摩尔体积乘积来计算混合气体的平均摩尔质量。
(1)通过以下换算,先计算非标准状况下气体的摩尔体积,进而再计算混合气体的平均摩尔质量:
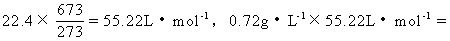
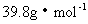
所以混合气体平均分子量为:39.8

(3)B的系数x=2
(4)在相同状况下,密度比等于其摩尔质量比。所以密度比为:1.16
[状元纠错] (1)达到平衡后混合气的平均摩尔质量为:
11] 在一密闭容器中通入A、B两种气体,在一定条件下反应:
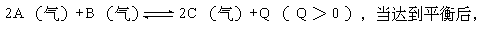
改变一个条件(X),下列量(Y)一定符合图1-13-2中曲线的是:
|
|
X |
Y |
|
A |
温度 |
混合气体平均相对分子质量 |
|
B |
压强 |
B的浓度 |
|
C |
再加入A |
B的转化率 |
|
D |
再加入C |
A的质量分数 |
[解析]本题是一道因外界条件改变,引起平衡移动的综合题。平衡移动必然引起浓度、质量分数、转化率……等量的变化,其中转化率……等是单因素引起变化(转化率中的变化量因条件而改变,而起始量不变),判断较为简单;而浓度、质量分数……等是诸多因素引起的变化(质量分数中的该物质和总物质都在变),必须找出其中主要因素,判断变化的结果。
[状元纠错]本题的误区多产生于由两种以上因素决定一个量的变化,由于分不清主、次,往往得出错误判断。如混合气体平均相对分子质量,它是由混合气体的总质量和混合气体的总物质的量两方面决定的。对于一般气相反应来说,只要产物不是液态或固态,混合气体的总质量就不变,而混合气体的总物质的量就视反应前后气体总体积数的变化,它决定了混合气体平均相对分子质量大小变化。如果有液、固相物质参与或生成,问题将变得 更为复杂。又如浓度,若是单一种浓度引起平衡移动,其结果显而易见;若是加压引起,问题变为复杂。以教材的“针管实验”中二氧化氮为例,加压引起气体体积减小,气体的浓度增大;平衡移动,气体的浓度又减小,但该浓度比加压前大(本题B选项应为正确选项),比加压后平衡移
更为复杂。又如浓度,若是单一种浓度引起平衡移动,其结果显而易见;若是加压引起,问题变为复杂。以教材的“针管实验”中二氧化氮为例,加压引起气体体积减小,气体的浓度增大;平衡移动,气体的浓度又减小,但该浓度比加压前大(本题B选项应为正确选项),比加压后平衡移 动前的浓度小。反之减压的结果,气体的浓度由大变小(体积增大);由小变大(平衡移动),但移动后的浓度仍比减压前的小。再如物质的质量分数也是多因素决定的,它是由该物质的变化和所有物质的变化比较而得,因此判断容易产生失误。如加入C,增大C的浓度,平衡向逆反应方向移动。由于C增加的比平衡移动而引起A的增加要多,虽然A的浓度增大,物质的量增多,但A的质量分数并不增大。
动前的浓度小。反之减压的结果,气体的浓度由大变小(体积增大);由小变大(平衡移动),但移动后的浓度仍比减压前的小。再如物质的质量分数也是多因素决定的,它是由该物质的变化和所有物质的变化比较而得,因此判断容易产生失误。如加入C,增大C的浓度,平衡向逆反应方向移动。由于C增加的比平衡移动而引起A的增加要多,虽然A的浓度增大,物质的量增多,但A的质量分数并不增大。
10]某温度下,一定量的混合气体在密闭容器中发生如下反应:

当达到新平衡时,C的浓度为原来的1.9倍,其压缩过程中保持温度不变,则反应方程式中两边系数关系是:
[答案] m+n<p。
[解析]温度一定 ,气体的体积缩小到原来的二分之一,所有物质的浓度都发生相应的变化,相当于给体系加压,应从压强条件改变,引起平衡移动进行讨论。但讨论某物质的浓度变化时,不仅要从平衡移动方面(化学变化)考虑。还要从压强引起体积变化,进而引起浓度变化(物理因素)方面考虑。若从单方面分析,必然得出错误的结论。如:仅从加压引起平衡移动考虑,C的
,气体的体积缩小到原来的二分之一,所有物质的浓度都发生相应的变化,相当于给体系加压,应从压强条件改变,引起平衡移动进行讨论。但讨论某物质的浓度变化时,不仅要从平衡移动方面(化学变化)考虑。还要从压强引起体积变化,进而引起浓度变化(物理因素)方面考虑。若从单方面分析,必然得出错误的结论。如:仅从加压引起平衡移动考虑,C的 浓度为原来的1.9倍,一定是平衡向正反应方向移动的结果,反应物气体的总物质的量大于生成物气体的总物质的量,即m+n=p。
浓度为原来的1.9倍,一定是平衡向正反应方向移动的结果,反应物气体的总物质的量大于生成物气体的总物质的量,即m+n=p。
本题考虑到体积缩小到原来的二分之一这一瞬间,所有物质的浓度将增大到原来的二倍,C的浓度也应为原来的二倍。题目给的有关达到新平衡时C的浓度为原来的1.9倍,意味着平衡是向逆反应方向移动。因此,结论为:m+n<p。
[状元纠错]m+n>p
9]
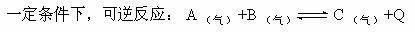
达到平衡。为了满足以下要求,可以采取哪些措施。①使B物质 的转化率增大,②使A,B物质的转化率都增大,③使A物质的转化率增大,使B物质的转化率降低,④使B的浓度降低。
的转化率增大,②使A,B物质的转化率都增大,③使A物质的转化率增大,使B物质的转化率降低,④使B的浓度降低。
 变浅(体积关系),再由浅变深(平衡移动),但第二次的深比第一次的深要浅
变浅(体积关系),再由浅变深(平衡移动),但第二次的深比第一次的深要浅
[状元纠错]④增大A的浓度;减小C的浓度;降低温度。
8]某温度下,向某密闭容器中加入1mol氮气和3mol氢气,使之反应合成氨,平衡后,测得氨的体积分数为m。若温度不变,只改变起始加入量,使之反应重新达平衡后,氨的体积分数仍然为m。若氮气、氢气和氨的加入量用x,y,z表示,应满足:
(1)温度、体积恒定时:若x=0,y=0则z=_______。
温度、压强恒定时:若x=0,y=0则z_______。
(2)温度、体积恒定时:若x=0.75mol,y_______,z_______。
温度、压强恒定时:若x=0.75mol,y_______,z_______。
(3)温度、压强恒定时:x,y,z应满足的关系是__________。
[答案]
(1)温度、体积恒定时:z=2mol,温度、压强恒定时:z>0。
(2)温度、体积恒定时:y=2.25mol,z=0.5mol,
温度、压强恒定时:y=2.25mol,z≥0。
(3)温度、压强恒定时:x,y,z应满足的关系是y=3x,z≥0。
[解析]温度、体积恒定时,为了使达到平衡时氨的体积分数保持不变,加入的量必须和初始加入的量相当,即全为反应物应是1mol氮气和3mol氢气;全为生成物应是2mol氨气(若反应物、生成物皆有,折算为上述量)。但遇到温度、压强恒定时,由于思维定势,往往也取相当量,只能得出所有满足条件中的一个特殊情况。
实际上为了满足温度、压强恒定,只需根据体积大小,加入与初始相当的量即可满足题目的要求。如:假设本题的初始体积为VL,加入1mol氮气和3mol氢气,平衡后,测得氨的体积分数为m。而当体积改为2VL时,应加入2mol氮气和6mol氢气(或4mol氨,或其他相当的量),相当于每VL里仍加入1mol氮气和3mol氢气,平衡后,氨的体积分数不变,仍为m;……。因此,z的取值由体积大小而定,若无反应物,z为大于零的任意值;若有反应物,z为大于等于零的任意值。
[状元纠错](1)温度、压强恒定时:z=2mol
(2)温度、压强恒定时:z=0
(3)温度、压强恒定时:y=3x,z=2-2x
7] 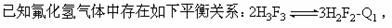
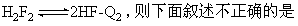
A.若气体平均相对分子质量为42,则H3F3的体积分数小10%
B.若气体平均摩尔质量为40g·mol-1,则H3F3的体积分数为10%
C.定温定容下再充入H3F3,则H3F3与HF的浓度比值增大
D.定温定容下再充入HF,则H3F3与HF的浓度比值增大
 对于只有一种反应物的化学平衡的体系,浓度变化若从压强变化分
对于只有一种反应物的化学平衡的体系,浓度变化若从压强变化分
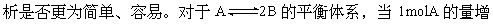
加到2mol时,可假设将体积扩大到原状态的两倍,这样2molA的起始状态(反应物的浓度,体系的压强、温度)和原状态相同。达到平衡时,各物质的浓度,百分组成……都不变。但体积仍是原两倍,各物质的物质的量是原状态的两倍。再将体积压缩到原状态。由于该平衡是气体体积增大的反应,加压后平衡向逆反应方向移动,各种量发生相应的变化。与本题有关的量是A的百分含量,不管是增加H3F3或HF,平衡都向逆反应方向移动,所以A%都是增加。本题的另一巧合是生成物也只有一种,这样H3F3与HF的浓度比值可视为A与100-A的比值大小,平衡移动后显而易见,结论是不管是增加H3F3或HF,H3F3与HF的浓度比值都增大。
[状元纠错]上述的分析方法,即提出假设,找出一种中间状态(参照物)比较,然后再得出结论,在其他学科经常使用,不妨在化学中也可试试。
6]一真空密 闭容器中盛有amolA,加热到200℃时发生如下反
闭容器中盛有amolA,加热到200℃时发生如下反

数为M%。若在同一温度和同一容器中,最初投入的是2amolA,反应平衡时,A所占体积分数为N%。则M和N的正确 关系是
关系是
A.M>N B.M<N C.M=N D.无法比较
[答案]D
[解析]在同温、同体积条件下,反应物投入的量由amol增加到2amol,讨论A所占体积分数如何变化。
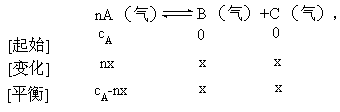
由于A所占体积分数受到两方面的制约,即A的大小(cA-nx)和总体积的大小(cA-nx+2x),而这两个量都是变量,因此其比值如何变化难以确定。另一方面反应物只有一种物质,增加其量是从增大浓度分析还是从加大压强考虑。知识的缺陷和分析方法的不当,往往得出以上各种错误的选择。
本题一种 简捷思考方法是:当A的量增大一倍时,先将容器的体积也扩大一倍(其状况和第一次完全相同),这样达到平衡时,A所占体积分数不变。然后再将体积压缩到原状态,这时根据反应前后的气体体积数如何变化,考虑平衡如何移动,决定A所占体积分数如何变化。如当本题反应物A前的系数n等于1,由于反应前气体的总体积数小于反应后气体的总体积数,因此在压缩到原状态时,
简捷思考方法是:当A的量增大一倍时,先将容器的体积也扩大一倍(其状况和第一次完全相同),这样达到平衡时,A所占体积分数不变。然后再将体积压缩到原状态,这时根据反应前后的气体体积数如何变化,考虑平衡如何移动,决定A所占体积分数如何变化。如当本题反应物A前的系数n等于1,由于反应前气体的总体积数小于反应后气体的总体积数,因此在压缩到原状态时,
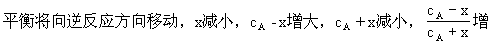
大,A所占体积分数增大,即N>M。若n等于3,由于反应前气体的总体积数大于反应后气体的总体积数,因此在压缩到原状态时,平衡将

减少,A所占体积分数减小,其结果为M>N。若n等于2,在压缩到原状态时,平衡不移动,其结果为M=N。
[状元纠错]由于A所占体积分数受到两方面的制约,即A的大小和总体积的大小,而这两个量都是变量,其比值如何变化难以确定。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com