
10.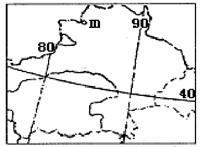 喀什市是新疆南部经济中心,有学者建议,建设以
喀什市是新疆南部经济中心,有学者建议,建设以
喀什为中心的中亚、南亚经济圈。m市近年来成为
我国重要的边境贸易口岸,原因是 ( )
A.我国西气东输工程的起点
B.位于第二条亚欧大陆桥沿线
C.工业发达,商品丰富
D.附近人口密度大,市场广阔
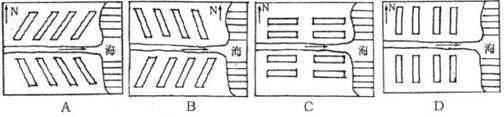
城市“热岛”效应加剧城市用能的供需矛盾。科学预测风向和合理城市规划能有效缓解“热岛”现象。据此完成8-9题。
8.下列城市地域形态不利于缓解“热岛”现象的是 ( )
A.集中式 B.组团式 C.条带式 D.放射式
9.下列城市建筑格式中,既利于建筑物前后采光,又利于夏季海风送爽的是 ( )
7.读“我国局部地区某月等温线图” .图中a、b
两处的气温是 ( )
A.a<28 ℃,b>16 ℃
B.a>28 ℃,b>16 ℃
C.a>28 ℃,b<16 ℃
D.a<28 ℃,b<16 ℃
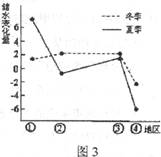 某地储水变化量为该地水量收入与支出之差。图3为4个不同流域多年平均储水变化量图。据此回答5-6题。
某地储水变化量为该地水量收入与支出之差。图3为4个不同流域多年平均储水变化量图。据此回答5-6题。
5.图中②地的植被主要为 ( )
A.亚热带常绿硬叶林
B.温带草原
C.亚寒带针叶林
D.热带季雨林
6.塑造图中④地区域地形地貌的主要力量来自( )
A.流水
 B.风力
B.风力
C.冰川
D.海浪
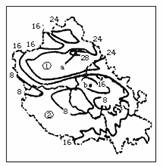
 读图2回答3-4题。
读图2回答3-4题。
3.九州一帕劳海岭
A.位于亚欧板块上
B.位于印度洋板块上
C.位于太平洋板块上
D.是太平洋板块和印度洋板块的界线
4.因板块挤压引发的地震多位于图中的 ( )
A.①②之间 B.②③之间 C.③④之间 D.④附近
读地球自转线速度随纬度变化图(甲)和地球公转速度变化图(乙),回答1-2题。
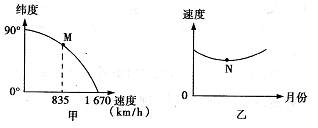
1.甲图中 M 点的纬度、乙图中 N 点对应的月份分别是 ( )
A.30° 1 月 B.60° 7 月
C.60° 1月 D.30° 7 月
2.当公转速度为N时 ( )
A漠河市民欢度“白夜” B.新西兰南部海域冰山座座
C.松花江畔银装素裹 D.悉尼处于雨季
19].将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 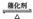 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是 。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是 。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
[错误分析](1).错选d,e, 认为SO3的生成速率与SO2的消耗速率分别代表正逆两个方向
(2).错选c,认为催化剂可以提高转化率
(3).计算时错将氧气量全部带入计算
(4).混合气体中只有SO3可以使BaCl2产生沉淀,多数同学错将SO2和SO3的物质的量都带入计算。
[答案](1)bc (2)b
(3)消耗的O2物质的量: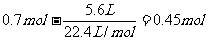
生成的SO3物质的量: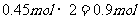

18] “碘钟”实验中,3I-+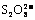 =I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
=I3- +2SO42 -的反应速率可以用I3- 与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20 ℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/ mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(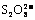 )/mol·L-1 )/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t1 |
回答下列问题:
(1)该实验的目的是___________________________________________________。
(2)显色时间t1=______________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40 ℃下进行编号③对应浓度的实验,显色时间t2的范围为______(填字母)。
(A)<22.0 s (B)22.0 s-44.0 s (C)>44.0 s (D)数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是_________________________________________。
[错误分析]错误示例;(1). 浓度对反应速率的影响(4).浓度越大反应速率越快。
[状元纠错]考查学生对影响化学反应速率的外界因素(如浓度、温度)及其规律的认识和理解;考查学生对图表的观察、分析以及处理实验数据归纳出合理结论的能力。
[答案] (1)研究反应物I-与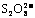 的浓度对反应速率的影响。 (2)29.3
s。
(3)A。
的浓度对反应速率的影响。 (2)29.3
s。
(3)A。
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)。
17]金属镁和0.1mol·L-1的HCl反应制取氢气,反应速率过快不易收集。为了减缓反应速率,又不减少产生氢气的量,加入下列试剂不能达到上述要求的是
A.硫酸钠溶液 B.醋酸钠固体
C.碳酸钠固体 D.水
[答案]C
[解析]盐酸是强电解质,在水中全部电离,氢离子浓度较大,反应速率较快。为了减缓反应速率,又不减少产生氢气的量,只能降低氢离子浓度,而又不改变氢离子的物质的量。一种方法是加水稀释;另一种方法是加入弱酸盐(如醋酸钠),使强酸转化为弱酸。弱酸部分电离,氢离子浓度有所下降,反应速率减缓,而酸提供的氢离子物质的量又不变。
[状元纠错]本题的误区之一是认为碳酸钠也可达到上述要求,由于当盐酸转化为碳酸后,本身碳酸是一种易分解的弱酸,而且二氧化碳在水中、酸中的溶解度较小。因此,氢离子的物质的量将减少,不能满足题目的要求,选项C是正确答案。本题的另一误区是,由于思维定势只顾硫酸钠不起作用,忽略了溶液中的水起到稀释氢离子浓度的作用,选项A不为本题的答案。
16]图1-13-1适合哪类化学反应,在t1时因哪种条件改变而引起正、逆反应速率的变化。
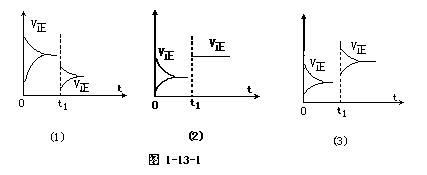
[答案] (1)适合正反应是吸热反应,当温度降低时或气体总体积缩小的反 应,当压强减小时引起正、逆反应速率的变化。
应,当压强减小时引起正、逆反应速率的变化。
(2)适合气体总体积不变的反应,当压强增大时或所有反应,使用正催化剂引起正、逆反应速率的变化。
(3)适合反应物能有浓度变化的反应,当某一反应物浓度增大时引起正、逆反应速率的变化。
[解析]影响化学反应速率的因素很多,但影响的结果一般可以分为两类:①正、逆反应速率都改变,如图1-13-1(1)(2),②正、逆反应速率中,只有一种改变,如图1-13-1(3)。
(2)在t1时,正、逆反应速率都增大,而且增加量相同,很容易得出是由于使用催化剂引起正、逆反应速率等量变化,而且平衡还不移动的结论。但是这里还存在另一种特殊情况,即对于反应前后气体总体积不变的反应来说,增大压强,正、逆反应速率都增大;由于增加量相同,平衡也不发生移动。
(3)对于该变化图像来说,在t1时,正反应速率增大,而逆反应速率不变,起因于反应物的浓度增大。但适合的反应必须是反应物中存在有浓度变化的物质,否则对于固体、纯液态物质,增加其量(若不考虑反应物接触面积的大小),它将不改变正反应速率,也不对平衡产生影响。
比较上述图1-13-1中正、逆反应速率的大小,还可以判断平衡移动的方向,即哪种速率大,平衡向该方向移动。
[状元纠错](2)适合使用正催化剂引起正、逆反应速率都变化的所有反应。(3)适合所有反应,当某一反应物浓度增大时引起正、逆反应速率的变化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com