
15.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
b |
|
|
|
c |
d |
e |
f |
|
|||||||||
|
g |
h |
i |
j |
|
k |
l |
m |
||||||||||
|
n |
|
|
|
|
|
|
o |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)请写出元素“o”的基态原子电子排布式
(2)k在空气中燃烧产物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(3)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 ,试从结构角度加以解释:
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
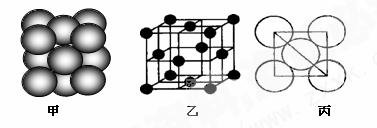
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
①晶胞中i原子的配位数为__ _ ____。
②该晶体的密度为__ ____(用字母表示)。
 5.B[解析]分子的极性一般与物质的空间结构有关,空间结构对称的属于非极性分子,反之属于极性分子。对于ABn分子,其经验规则是中心原子A的化合价的绝对值若等于最外层电子数,则属于非极性分子,反之属于极性分子,当然根据分子的极性也可以判断它的空间结构。键的极性只与是否属于同种非金属有关,而物质的稳定性与化学键的键能有关,一般,非金属性越强,所对应的气态氢化物越稳定。所以选项A中CO2属于非极性分子;选项C中HF、HCl、HBr、HI的稳定性减弱;选项D中的H2O属于V型结构。
5.B[解析]分子的极性一般与物质的空间结构有关,空间结构对称的属于非极性分子,反之属于极性分子。对于ABn分子,其经验规则是中心原子A的化合价的绝对值若等于最外层电子数,则属于非极性分子,反之属于极性分子,当然根据分子的极性也可以判断它的空间结构。键的极性只与是否属于同种非金属有关,而物质的稳定性与化学键的键能有关,一般,非金属性越强,所对应的气态氢化物越稳定。所以选项A中CO2属于非极性分子;选项C中HF、HCl、HBr、HI的稳定性减弱;选项D中的H2O属于V型结构。
14.镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
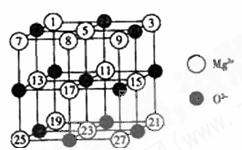
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如右图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氧化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合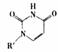 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
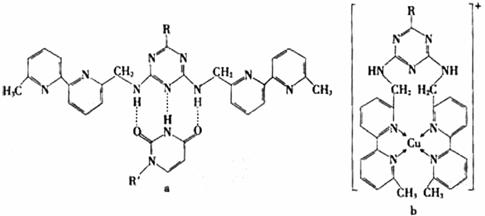
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
。
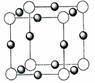
13.氮是地球上极为丰富的元素。
(1)Li3N 晶体中氮以 N3-存在,基态N3-的电子排布式为 。
(2) N≡N的键能为 942 kJ·mol-1 , N-N 单键的键能为 247kJ·mol-1,计算说明N2 中的 键比 键稳定(填“σ ”或“π ”)。
(3)(CH3)3
NH+ 和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100 ℃ ,其挥发性一般比有机溶剂 (填“大”或“ 小” ) ,可用作 (填代号)。
小” ) ,可用作 (填代号)。
 a.助燃剂
a.助燃剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
(4) x+中所有电子正好充满 K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是 ,与同一个N3-相连的x+今有 个。
12. W、X、Y、Z是原子序数依次增大的同一短同期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为 。
(2)W与Y 可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性 > (用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式: 。
11. X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为 、 ;
(2)XZ2与YZ2分子的立体结构分别是 和 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 ;
(3)Q的元素符号是 ,它属于第 周期,它的核外电子排布式为 ,在形成化合物时它的最高化合价为 ;
(4)用氢键表示式写出 E的氢化物溶液中存在的所有氢键
。
E的氢化物溶液中存在的所有氢键
。
10.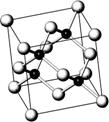 砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措,已知砷化镓的晶胞结构如右图。试回答下列问题
(1)下列说法正确的是 (选填序号)。
A.砷化镓晶胞结构与NaCl相同 B.第一电离能:As>Ga
C.电负性:As>Ga D.砷和镓都属于p区元素
E.半导体GaP、SiC与砷化镓为等电子体
(2)砷化镓是将(CH3)3Ga和AsH3用MOCVD方法制备得到, 该反应在700℃进行,反应的方程式为:  。AsH3空间形状为:
(CH3)3Ga中镓原子杂化方式为:
。
。AsH3空间形状为:
(CH3)3Ga中镓原子杂化方式为:
。
(3)Ga的核外电子排布式为: 。
(4)AsH3沸点比NH3低,其原因是: 。
9.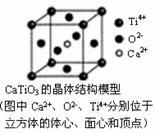 下列关于晶体的说法正确的组合是( )
下列关于晶体的说法正确的组合是( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
8.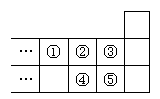 右图是元素周期表的一部分,下列说法中正确的是
右图是元素周期表的一部分,下列说法中正确的是
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物酸性:⑤>④
D.元素的最高正化合价:③=⑤
7. X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )
A.由mXa+与nYb-得,m+a=n-b
B.X2-的还原性一定大于Y-
C.X、Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
6.根据表1信息,判断以下叙述正确的是( )
表1 部分短周期元素的原子半径及主要化合价
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.112 |
0.104 |
0.066 |
|
主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com