
5.如图所示,从F处释放一个无初速的电子向B极方向运动,指出下列对电子运动的描述中哪句是错误的(设电源电动势为U)

A.电子到达B板时的动能是UeV
B.电子从B板到达C板动能变化量为零
C.电子到达D板时动能是3 eV
D.电子在A板和D板之间做往复运动
4.离子发动机飞船,其原理是用电压U加速一价惰性气体离子,将它高速喷出后,飞船得到加速,在氦、氖、氩、氪、氙中选用了氙,理由是用同样电压加速,它喷出时
A.速度大 B.动量大
C.动能大 D.质量大
3.如图所示,虚线a、b和c 是某静电场中的三个等势面,它们的电势分别为φa、φb和φc,φa>φb>φc,一带正电的粒子射入电场中,其运动轨迹如实线KLMN所示,由图可知
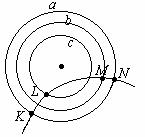
A.粒子从K到L的过程中,电场力做负功
B.粒子从L到M的过程中,电场力做负功
C.粒子从K到L的过程中,静电势能增加
D.粒子从L到M的过程中,动能减小
2.如图所示,平行板电容器经开关S与电池连接,a处有一电荷量非常小的点电荷,S是闭合的,φa表示a点的电势,F表示点电荷受到的电场力.现将电容器的B板向下稍微移动,使两板间的距离增大,则
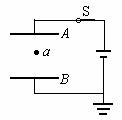
A.φa变大,F变大 B.φa变大,F变小
C.φa不变,F不变 D.φa不变,F变小
1.1999年7月12日日本原子能公司所属敦贺湾核电站由于水管破裂导致高辐射冷却剂外流,在检测此次重大事故中应用了非电量变化(冷却剂 外泄使管中液面变化)转移为电信号的自动化测量技术.图是一种通过检测电容器电容的变化来检测液面高低的仪器原理图,容器中装有导电液体,是电容器的一个电极,中间的芯柱是电容器的另一个电极,芯柱外面套有绝缘管(塑料或橡皮)作为电介质,电容器的两个电极分别用导线接在指示器上,指示器上显示的是电容的大小,但从电容的大小就可知容器中液面位置的高低,为此,以下说法中正确的是
A.如果指示器显示出电容增大了,则两电极正对面积增大,必液面升高
B.如果指示器显示电容减小了,则两电极正对面积增大,必液面升高
C.如果指示器显示出电容增大了,则两电极正对面积减小,液面必降低
D.如果指示器显示出电容减小了,则两电极正对面积增大,液面必降低
15.(1)1s22s22p63s23p63d64s2 (2)角形(或V形) sp2 极性 (3)SiC 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高。(4)12
[解析](1)根据周期表的图示,知
“O”为Fe。(2)k为S元素,燃烧产物为SO2,根据VSEPR可知,它有一对孤对电子,S原子为sp2杂化。(3)SiC和晶体Si均为原子晶体,熔沸点的比较则看原子半径,小的熔沸点高。(4)从晶胞看,应为金属堆积方式中的铜型,配位数为12,从图乙中知,一个晶胞中含有 个原子,其质量为
个原子,其质量为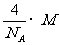 ;由丙图知,边长为
;由丙图知,边长为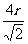 ,根据
,根据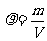 即可得出结果。
即可得出结果。
13.(l) 1s22s22p6 (2)π σ (3)小 b (4)Cu 6
[解析](1)N3-应与稀有气体Ne具有相同的电子排布式。(2)氮气分子中含有1个σ键与2个π键,根据题中提供的键能可得N-N π键为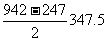 KJ·mol-1,故π键比σ键
KJ·mol-1,故π键比σ键 [解析]本题主要考查了晶胞中粒子的排布,不同晶体熔沸点的比较以及微粒间的作用力。(2)迁移考查NaCl晶胞中粒子的排列;(4)熔沸点的比较规律;(5)①比较σ、π间的区别;②氢键和配位键的表示方法不同,氢键用“……”,配位键用“→”表示。
[解析]本题主要考查了晶胞中粒子的排布,不同晶体熔沸点的比较以及微粒间的作用力。(2)迁移考查NaCl晶胞中粒子的排列;(4)熔沸点的比较规律;(5)①比较σ、π间的区别;②氢键和配位键的表示方法不同,氢键用“……”,配位键用“→”表示。
8.C [解析]从图上分析,①不可能为位于第二周期第ⅣA族,因为这样③后面的元素应为F,而F上面是不存在元素的,故A项错;②④位于同主族,从上至下,非金属性减弱,所对应的 气态氢化物的稳定性减弱,故B项错;④⑤位于同周期,从左向右,非金属性增强,所对应的最高价氧化物对应水化物酸性增强,C项正确;元素③应为F,而F没有最高正价,D项错。
气态氢化物的稳定性减弱,故B项错;④⑤位于同周期,从左向右,非金属性增强,所对应的最高价氧化物对应水化物酸性增强,C项正确;元素③应为F,而F没有最高正价,D项错。
 (4)NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键。
(4)NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键。
[解析]本题以第三代半导体砷化镓为背景,全面考查原子结构与性质、分子结构及晶体结构知识灵活掌握程度,另一方面通过LED推广使用形成节能减排价值取向和环境友好的消费情趣。这类试题常常是通过小背景作为生长点,融合物质的结构与性质大部分知识内容。
11.(1)S C (2)V形 直线形 SO2 因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大(3)Cr 四 1s22s22p63s23p63d54s1 +6 (4)F-H…F F-H…O O-H…F O-H…O
[解析]此题主要考查了电子排布式,分子的空间构型,分子的极性,“相似相溶”原理以及氢键的表示方法。题型属于推断式,首先要正确的推出所有元素,然后再回答相应问题。
12.(1)Al(OH)3+
OH-=AlO2- +2H2O(2)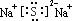 (3)酸 Al3++3H2O
(3)酸 Al3++3H2O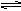 Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+ 2HCl(5)HCl>H2S (6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJmol-1
Al(OH)3+3H+
(4)SO2+Cl2+2H2O=H2SO4+ 2HCl(5)HCl>H2S (6)S2->Cl->Na+>Al3+ (7)Cl2O7(l)+H2O(l)=2HClO4(aq);△H=-4QkJmol-1
[解析]根据W、X、Y、Z是的同一短同期原子序数递增的元素,且W、X的最高价氧化物对应的水化物可以反应生盐和水,确定出W、X分别为Na和Al;由W与Y形成W2Y可以确定Y为S,Y的低价氧化物(SO2)与Z单质的水溶液反应可以确定Z为Cl,确定出四种元素其它的问题便迎刃而解。X的硝酸盐即Al(NO3)3属于强酸弱碱盐,水解显酸性。对于电子层结构相同的不同离子,核电荷数越小,离子半径越大,即S2- >Cl->Na+>Al3+;Z的最高价氧化物为Cl2O7,0.25mol与水反应放出QkJ热量,则1mol放出4QkJ的热量,可以写出对 应的热化学方程式。
应的热化学方程式。
7.B [解析]X、Y均为周期表的前20号元素,其简单离子的电子层结构相同,A项,对于阳离子,核外电子数为m-a,对于阴离子,核外电子数为n+b,故A项错; X2-与Y-电子层结构相同,则它们应位于同一周期,且X在Y的前面,Y的非金属性强于X,所对应的离子的还原性: X2->Y-,B项正确; S2-与Cl-电子层结构相同且位于同一周期,C项错误;X的原子半径大于Y,故X的非金属性弱于Y,其气态氢化物的稳定性也弱于Y,D项错误。
6.C [解析]T只有-2价,且原子半径小,所以T为O元素;R的最高正价为+6价,最低价为-2价,所以R为S元素;L的原子半径最大,化合价为+2价,所以L为Mg;M的原子半径介于Mg和S之间且化合价为+3价,所以M为Al;而Q的原子半径在Mg和O之间且化合价为+2价,所以Q为Be。选项A,由于H2O中存在氢键,所以沸点:H2T>H2R;选项B,由于Mg的金属性比Al强,所以与HCl反应的速率:L>Q;选项C,Al和Be的化合物具有两性;选项D,Mg2+只有两个电子层而S2-具有三个电子层。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com