
7、将PH=3的某酸溶液和PH=11的某碱溶液等体积混合溶液的PH
A、大于7 B、小于7 C、等于7 D、无法确定
6、下列液体中PH>7的是:
A、人体胃液 B、人体血液 C、蔗糖溶液 D、橙汁
5、在含Al3+、Fe3+、Fe2+、NH4+的稀溶液中,加入足量的Na2O2固体,充分作用后,再加入过量稀盐酸完全反应,离子数目基本不变的是:
A、Al3+ B、Fe3+ C、Fe2+ D、NH4+
4、下列平衡体系中,升温或减压都使平衡向正反应方向移动的是(△H<0表示放热):
A、N2(g)+3H2(g) 2NH3(g)△H<0
2NH3(g)△H<0
B、N2(g)+O2(g) 2NO3(g)△H<0
2NO3(g)△H<0
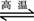 C、C(s)+H2O(g) CO2(g)+H2(g)△H>0
C、C(s)+H2O(g) CO2(g)+H2(g)△H>0
D、2SO2(g)+O2(g) 2SO3(g)△H<0
2SO3(g)△H<0
3、质量相等的两份铝粉,分别与足量的盐酸和氢氧化钠溶液反应,二者生成的氢气质量相比较:
A、前者多 B、后者多 C、一样多 D、不能确定
2、下列说法不正确的是:
A、实验室制取NH3的发生装置与用KClO3制取O2的装置相同
B、氨气的检验可以用湿润的蓝色石蕊试纸
C、白磷剧毒,红磷无毒
D、磷酸的酸性比硝酸弱,说明磷元素的非金属性比氮元素弱
1、可以充分说明可逆反应:P(g)+Q(g) R(g)+S(g),在恒温下达到平衡状态的是:
R(g)+S(g),在恒温下达到平衡状态的是:
A、反应器内压强不随时间而变化 B、反应器内P、Q、R、S气体共存
C、生成P的速率与生成S的速率相等 D、生成1molP必定有1molQ生成
25.(2010福建卷) 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除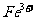 外还可能含有
外还可能含有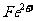 。若要确认其中的
。若要确认其中的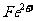 ,应先用 选填序号)。
,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水
d.酸性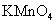 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
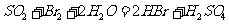
然后加入足量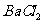 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中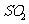 的体积分数为
。
的体积分数为
。
[探究二]
分析上述实验中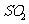 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有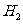 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
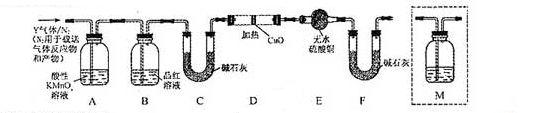
(3)装置B中试剂的作用是 。
(4)认为 气体Y中还含有Q的理由是
(用化学方程式表示)。
气体Y中还含有Q的理由是
(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有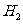 ,预计实验现象应是
。
,预计实验现象应是
。
(7)若要测定限定体积气体Y中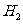 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml 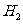 ),除可用测量
),除可用测量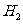 体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
解析: (1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉钝化阻止反应进一步进行
(2)+2价亚铁离子能使算话的高锰酸钾褪色,溶液中已经有+3价铁离子,选择a会造成干扰,选c会造成两种沉淀,受氢氧化铁颜色的影响无法辨别
(3)A除去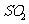 ,B可以检验A中是否完全除去
,B可以检验A中是否完全除去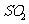
(4)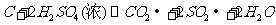
(5)Q为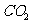 ,他与二氧化硫一样都能使澄清石灰水便浑浊,选择a或b受二氧化硫的影响无法判断Q的存在;选择d,Q被碱石灰吸收
,他与二氧化硫一样都能使澄清石灰水便浑浊,选择a或b受二氧化硫的影响无法判断Q的存在;选择d,Q被碱石灰吸收
(6)氢气还原氧化铜会生成水蒸气能使白色的硫酸铜粉末变蓝
(7)中学阶段的质量称量选择托盘天平,分度值0.1g,无法精确称量出差量。
28.(2010安徽卷)(13分)某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
[实验]制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
[提出假设]
假设1:Fe1+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3能氧化Ag。
[设计实验方案,验证假设]
(2)甲同学从上述实验的生成物中检验出Fe3+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式: 。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示: NO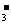 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
|
实验步骤(不要求写具体操作过程) |
预期现象和结论 |
|
① ② …… |
若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
[思考与交流]
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO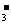 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由: 。
答案(1)ade
(2)Fe3++Ag= Fe2++Ag+
(3)①将银镜在硝酸铜溶液中
(4)同意 4Fe3++6H2O+9Ag+3NO3-=4Fe(OH)3+9Ag++3NO
解析:本题第(1)小题是考查学生实验,最后2小题具有较大的开放度。
28.(2010全国卷1)(15分)有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
[解析](I)由题干表述可知A和E不是盐,又由纯E为无色油状液体,推知E为硫酸(③步操作进一步确定);(II)由题干和①步操作可知A为氨水; (III)再由②步操作可知F中阳离子为Ag+发生的反应为:Ag++NH3·H2O=AgOH↓+NH4+;AgOH+2NH3·H2O=[Ag(NH3)2]++OH-+2H2O;而常见的盐中只有AgNO3可溶于水,故F为AgNO3;(IV)由③步操作可知B中阴离子应为CO32-,由于此无色无味的气体只能是CO2, B、C、D中能生成沉淀说明不能是HCO3-,而阳离子可是常见的K+、Na+、NH4+等待定(V)同样由②步操作D中能与氨水生成沉淀的无色溶液中常见的为阳离子为Mg2+或Al3+,而阴离子需待下步反应再确定;(VI)由④步操作生成的沉淀为可能为AgCl、AgBr、AgI、BaSO4、H2SiO3(不合理)等,但限于题干所述中学常用试剂,则沉淀应为AgCl和BaSO4,才不溶于HNO3,一个是与AgNO3结合生成的沉淀,一个是与硫酸结合形成的沉淀,故C应该同时含有Ba2+和Cl-即,C为BaCl2,进而推出D中阴离子应该为SO42-,因为题干所述盐溶液中阴离子均不同,故D为Al2(SO4)3或MgSO4其他解析见答案
[答案](1)A NH3·H2O或NH3 ;E H2SO4 F AgNO3 C BaCl2
若C作为不能确定的溶液,进一步鉴别的方法合理,同样给分
(2)B Na2CO3或K2CO3 用洁净的铂丝蘸取少量B,在酒精灯火焰中灼烧,若焰色呈黄色则B为Na2CO3溶液;若透过蓝色钴玻璃观察焰色呈紫色,则B为K2CO3溶液
D Al2(SO4)3或MgSO4 取少量D,向其中滴加NaOH溶液有沉淀生成,继续滴加过量的NaOH溶液,若沉淀溶解,则D为Al2(SO4)3溶液,若沉淀不溶解,则D为MgSO4溶液
[命题意图]考查学生的分析与综合能力,涉及到无机元素及其化合物的性质,离子反应,未知物的推断,物质的检验,常见物质量多与量少的反应不同,现象不同等,此题综合性强,难度大,区分度很好,是一道不可多得的经典好题!
[点评]此题一改过去每年元素推断的通病,思维容量显著增大能力要求高,与2008年全国卷I理综28题有得一拼,比2009年的第29题出得高超一些,相比以前的无机推断显然有质的飞跃,看到命题人在进步!但是此题是不是一点瑕疵没有呢?x显然不是,例如本题条件很宽广,没太明显的限制条件,因而答案是丰富多彩的,这不会给阅卷者带来喜出望外,只会增加难度,不好统一评分标准,也就缺乏公平性!特别是B和C上就有争议,如B还可能是(NH4)2CO3,C还可能是BaBr2、BaI2等,当然限制一下沉淀颜色就排除了C的歧义!
(2010广东理综卷)32(16分)
碳酸锂广泛应用于陶瓷和医药等领域。以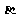 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O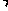 Al2O3
Al2O3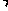 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:
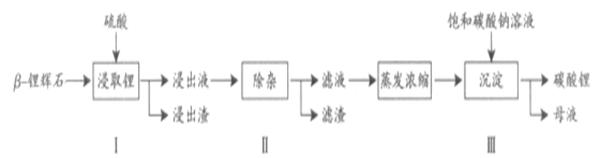
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,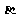 -锂辉石要粉碎成细颗粒的目的是_____________.
-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.
解析:(1)粉碎可以增大接触面积,加快反应速率
(2) 要增强溶液的碱性,只能加入石灰石
(3)
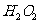 可以氧化
可以氧化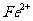 为
为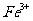 ,石灰乳和
,石灰乳和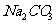 使得
使得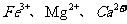 沉淀
沉淀
(4)
步骤Ⅲ生成的沉淀是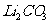 ,离子方程式为:
,离子方程式为: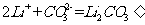
(5)
母液中的溶质是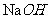 、
、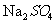 ,可以回收
,可以回收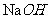 。
。
答案:(1)加快反应速率
(2)石灰石
(3)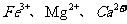
(4)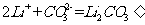
(5)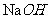 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com