
2、平衡常数表达式表明在一定温度条件下达成平衡的条件。
一个化学反应是否达到平衡状态,它的标志就是各物质的浓度将不随时间改变,而且产物浓度系数次方的乘积与反应物浓度系数次方的乘积之比是一个常数。如:
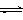 对任意一个可逆反应:mA+nB
pC+qD,其平衡浓度的比值,总是符合下列关系
对任意一个可逆反应:mA+nB
pC+qD,其平衡浓度的比值,总是符合下列关系
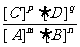 = K (是一个定值,称为化学平衡常数。)
= K (是一个定值,称为化学平衡常数。)
若用Qc表示任意状态下,可逆反应中产物的浓度以其化学计量系数为指数的乘积与反应物的浓度以其化学计量系数为指数的乘积之比,则这个比值称为浓度商。将浓度商和平衡常数作比较可得可逆反应所处的状态。
即 Qc = Kc 体系处于化学平衡
Qc<Kc 反应正向进行
Qc>Kc 反应逆向进行
可见只要知道一定温度下,某一反应的平衡常数,并且知道反应物及产物的浓度,就能判断该反应是平衡状态还是向某一方向进行。
[考点再现]
一、考查化学平衡常数表达式的书写
在一定温度下,当一个可逆反应达到化学平衡时,体系内所有反应物和生成物的浓度保持不变,所以生成物浓度幂(以其化学计量数为幂)之积与反应物浓度幂之积的比值就是一个常数,叫做该反应的化学平衡常数,简称平衡常数,用符号K表示。以反应:mA(g)+nB(g)pC(g)+qD(g)为例,K =
。
1.由于固体或纯液体的浓度是一常数,如果有固体或纯液体参加或生成,则表达式中不能出现固体或纯液体;稀溶液中进行的反应,如有水参加反应,由于水的浓度是常数而不必出现在表达式中;非水溶液中进行的反应,若有水参加或生成,则应出现在表达式中。例如:
(1)CaCO3(s)CaO(s)+CO2(g) K =c(CO2)
(2)3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g) K =
/
(3)Cr2O72-(l)+H2O(l)2CrO42-(l)+2H+(l) K =
(4)CH3COOH(l)+HOCH2CH3(l)CH3COOCH2CH3(l)+H2O(l)
K =
2.表达式与化学计量数一一对应,方程式中化学计量数不同,表达式就不同;可逆反应中,正反应的表达式与逆反应的表达式互为倒数。例如:
(1)N2(g)+3H2(g)2NH3(g) K1 =
(2)2NH3(g)N2(g)+3H2(g) K 2=
(3)1/2N2(g)+3/2H2(g)NH3(g) K 3=
同一温度下,K1、K 2、K 3的数值都固定但相互之间不相等,显然,K1 =,K 3=
。
1、平衡常数是反应进行程度的标志
一般认为K >105反应较完全,K<105反应很难进行。平衡常数的数值大小可以判断反应进行的程度,估计反应的可能性。因为平衡状态是反应进行的最大限度。如:
N2(g) + O2(g) 2NO(g) K = 1×10 - 30(298K)
2NO(g) K = 1×10 - 30(298K)
这意味着298K时,N2和O2基本上没有进行反应,反之NO分解的逆反应在该温度下将几乎完全进行,平衡时NO实际上全部分解为N2和O2。
另外还有两点必须指出:
(1)平衡常数数值的大小,只能大致告诉我们一个 可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:
可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如:
2SO2(g) + O2===2SO3(g) 298K时k很大,但由于速度太慢,常温时,几乎不发生反应。
(2)平衡常数数值极小的反应,说明正反应在该条件下不可能进行,如:N2 + O2 2NO
2NO
K = 10-30(298K)所以常温下用此反应固定氮气是不可能的。
3、由于水的物质的量浓度为一常数(55.6 mol·L-1),因平衡常数已归并,书写时不必写出。
2、由于固体浓度为一常数,所以在平衡常数表达式中不再写出。
1、化学平衡常数K表示可逆反应进行的程度。
(1)化学平衡常数K只针对达到平衡状态的可逆反应适用,非平衡状态不适用。
(2)化学平衡常数K的表达式与可逆反应的方程式书写形式有关。对于同一可逆反应,正反应的平衡常数等于逆反应的平衡常数的倒数,即:K正=1/K逆。
(3)K值越大,表示反应进行的程度越大,反应物转化率或产率也越大。
(4)K值不随浓度或压强的改变而改变,但随着温度的改变而改变。
(5)一般情况下, 对于正反应是吸热反应的可逆反应,升高温度,K值增大;而对于正反应为放热反应的可逆反应,升高温度,K值减少。
对于正反应是吸热反应的可逆反应,升高温度,K值增大;而对于正反应为放热反应的可逆反应,升高温度,K值减少。
在一定温度下,可逆反应无论从正反应开始还是从逆反应开始,无论反应混合物的起始浓度是多少,当反应达到平衡状态时,正反应速率等于逆反应速率,反应混合物中各组成成分的含量保持不变,即各物质的浓度保持不变。生成物浓度的幂次方乘积与反应物浓度的幂次方乘积之比是常数,这个常数叫化学平衡常数,用K表示。
化学平衡常数的计算公式为:
对于可逆反应:mA(g) + nB(g) pC(g) + qD(g)
pC(g) + qD(g)
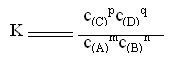
27.下面是三张为我国三个不同类型的农业区域,读图回答下列问题。
(1)甲图中特大城市是 ,以
工业著称。乙图所示地区在我国分布最典型的是 盆地,这里 将成为我国矿产中
生产基地。丙图所示地区的核电站名称是
。(5分)
将成为我国矿产中
生产基地。丙图所示地区的核电站名称是
。(5分)
(2)填写下表 (5分)
|
农业区名称 |
因地制 宜发展农业生产的措施 宜发展农业生产的措施 |
主要农产品 |
|
A: |
|
|
|
B: |
|
|
|
C: |
|
|
(3)近十几年来,随着丙地区开放的深入发展,农业生产逐步向经营蔬菜、花卉、瓜果等作物的商品农业发展。近年来,甚至出现大片出售、出租土地等现象。请运用农业区位原理分析,近十几年来,丙地区农业生产区位因素发生了什么深刻变化?(3分)
 2
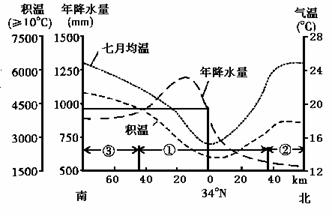
2 8.下图是我国境内111°E经线沿线的气候统计资料。据此完成下列问题。
8.下图是我国境内111°E经线沿线的气候统计资料。据此完成下列问题。
(1)填出序号代表的地形区名称。
① ② ③ 。
(2)该 经线沿线随地势变化的气温分布规律是
经线沿线随地势变化的气温分布规律是
(3)该经线沿线年降水量的分布规律是
(4)7月均温最低处的年降水量约为 mm。
(5)填表比较①地南北两侧自然条件及农业生产的差异。
|
|
热量带 |
干湿地区 |
积温 |
耕地类型 |
耕作制度 |
主要粮食作物 |
|
①地北侧 |
|
|
|
|
|
小麦 |
|
①地南侧 |
|
|
4500以上 |
水田 |
一年二熟 |
|
(6)中国①地形区以北以东地区常见的气象灾害有哪些?
(7)酸雨在中国①地形区以南地区可能造成的危害是什么?
25.D城市建设港口的有利区位条件有 ( )
A.纬度较低,港口水域全年不冻
B.位于河流人海口,常年不淤
C.地形平坦,便于港口建设,且腹地范围较广
D.海岸线平直,是天然良港,便于船舶进出和停泊
第Ⅱ卷(非选择题,共40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com