
21。 (19分)
(19分)
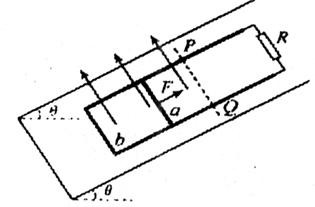 如图所示,两条平行的光滑金属导轨固定在倾角为θ的绝缘斜面上,导轨上端连接一个定值电阻。导体棒a和b放在导轨上,与导轨垂直开良好接触。斜面上水
如图所示,两条平行的光滑金属导轨固定在倾角为θ的绝缘斜面上,导轨上端连接一个定值电阻。导体棒a和b放在导轨上,与导轨垂直开良好接触。斜面上水 平虚线PQ以下区域内,存在着垂直穿过斜面向上的匀强磁场。现对a棒施以平行导轨斜向上的拉力,使它沿导轨匀速向上运动,此时放在导轨下端的b棒恰好静止。当a棒运动到磁场的上边界PQ处时,撤去拉力,a棒将继续沿导轨向上运动一小段距离后再向下滑动,此时b棒已滑离导轨。当a棒再次滑回到磁场上边界PQ处时,又恰能沿导轨匀速向下运动。已知a棒、b棒和定值电阻的阻值均为R,b棒的质量为m,重力加速度为g,导轨电阻不计。求
平虚线PQ以下区域内,存在着垂直穿过斜面向上的匀强磁场。现对a棒施以平行导轨斜向上的拉力,使它沿导轨匀速向上运动,此时放在导轨下端的b棒恰好静止。当a棒运动到磁场的上边界PQ处时,撤去拉力,a棒将继续沿导轨向上运动一小段距离后再向下滑动,此时b棒已滑离导轨。当a棒再次滑回到磁场上边界PQ处时,又恰能沿导轨匀速向下运动。已知a棒、b棒和定值电阻的阻值均为R,b棒的质量为m,重力加速度为g,导轨电阻不计。求
(1)a棒在磁场中沿导轨向上运动的过程中,a棒中的电流强度Ia与定值电阻中的电流强度Ic之比;
(2)a棒质量ma;
(3)a棒在磁场中沿导轨向上运动时所受的拉力F

 选考部分
选考部分
第Ⅱ卷选考部分共5题,共35分。其中第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若第28、29题都作答,则按第28题计分;若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
16.质量为2kg的物体静止在足够大的水平面上,物体与地面间的动摩擦因数为0.2,最大静摩擦力和滑动摩擦力大小视为相等。从t=0时刻开始,物体受到方向不变、大小呈周期性变化的水平拉力F的作用,F随时间t的变化规律如图所示。重力加速度g取10m/s2,则物体在t=0到t=12s这段时间内的位移大小为
A.18m B.54m C.72m D.198m
[命题特点]本题属于多过程问题,综合考查静摩擦力、滑动摩擦力、牛顿运动定律、匀速直线运动和匀变速直线运动,需要考生准确分析出物体在每一段时间内的运动性质。
[解析]拉力只有大于最大静摩擦力时,物体才会由静止开始运动
0-3s时:F=fmax,物体保持静止,s1=0;
3-6s时:F>fmax,物体由静止开始做匀加速直线运动
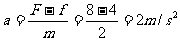
v=at=6m/s
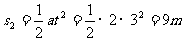
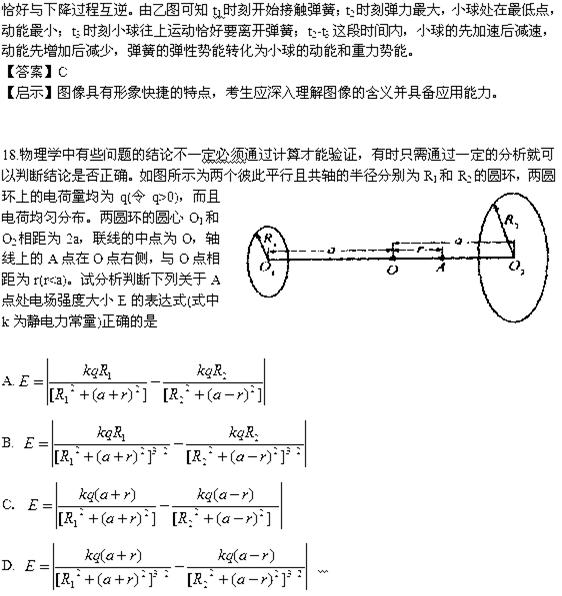
6-9s时:F=f,物体做匀速直线运动
s3=vt=6×3=18m
9-12s时:F>f,物体以6m/s为初速度,以2m/s2为加速度继续做匀加速直线运动
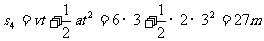
所以0-12s内物体的位移为:s=s1+s2+s3+s4=54m,B正确
[答案]B
 [启示]多过程问题能体现考生的判断力,组合题能综合考查学生多方面的知识,这类题目复习中应引起重视。
[启示]多过程问题能体现考生的判断力,组合题能综合考查学生多方面的知识,这类题目复习中应引起重视。

 [答案]D
[答案]D
[启示]这是近两年高考新出现的一类题目,要求考生注意去 领会相关物理研究方法。
领会相关物理研究方法。
第Ⅱ卷(非选择题共192分)
必考部分
第Ⅱ卷必考部分共9题,共157分。
 ]9.(18分)
]9.(18分)
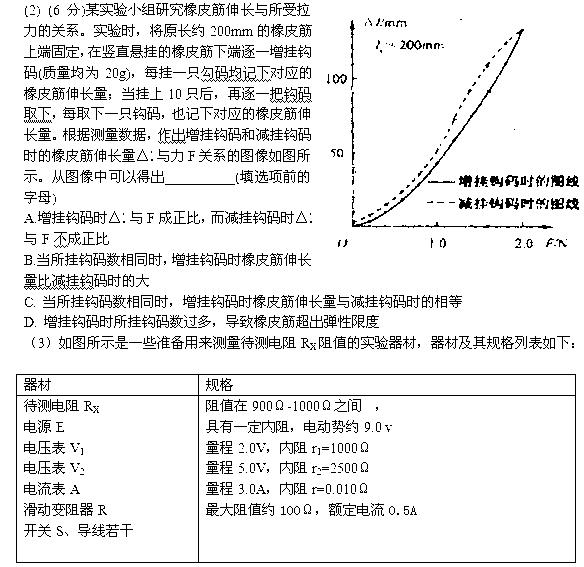 (1)(6分)某同学利用“插针法”测定玻璃的折射率,所用的玻璃砖两面平行,正确操作后,作出的光路图及测出的相关角度如图所示,①此玻璃的折射率计算式为n=________(用图中的θ1、θ2 表示);②如果有几块宽度大小不同的平行玻璃砖可供选择,为了减小误差,应选用宽度______________________.(填“大”或“小”)的玻璃砖采测量。
(1)(6分)某同学利用“插针法”测定玻璃的折射率,所用的玻璃砖两面平行,正确操作后,作出的光路图及测出的相关角度如图所示,①此玻璃的折射率计算式为n=________(用图中的θ1、θ2 表示);②如果有几块宽度大小不同的平行玻璃砖可供选择,为了减小误差,应选用宽度______________________.(填“大”或“小”)的玻璃砖采测量。

13.中国已投产运行的1000kV特高压输电是目前世界上电压最高的输电工程。假设甲、乙两地原采用500kV的超高压输电,输电线上损耗的电功率为P。在保持输送电功率和输电线电阻都不变的条件下,现改用1000kV特高压输电,若不考虑其他因素的影响,则输电线上损耗的电功率将变为
A.P/4 B.P/2 C.2P D.4P

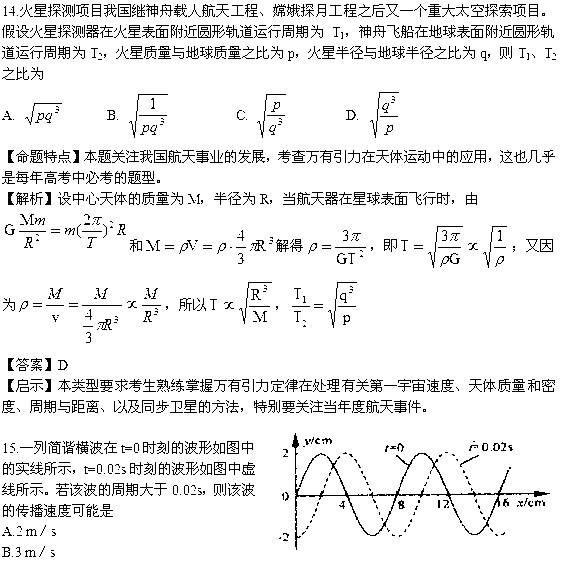
 当n=0时,T=0.08/3s>0.02s,符合要求,此时
当n=0时,T=0.08/3s>0.02s,符合要求,此时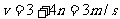
当n=1时,T=0.08/7s<0.02s,不符合要求
综上所述,只有B选项正确
[答案]B
[启示]波的双向性、每一个质点的起振方向、质点的运动特征(不随波逐流)、波长与波速间的联系、机械波与电磁波的比较是主要考查对象,在复习中应重点把握。
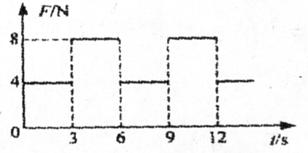
30. [化学-物质结构与性质] (13分)
[化学-物质结构与性质] (13分)
(1)中国古代四大发明之一--黑火药,它的爆炸反应为
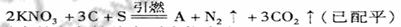
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为
③已知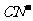 与
与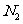 结构相似,推算HCN分子中
结构相似,推算HCN分子中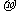 键与
键与 键数目之比为 。
键数目之比为 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,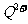 的未成对电子数是
。
的未成对电子数是
。
(3)在 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为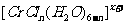 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
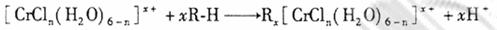
交换出来的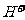 经中和滴定,即可求出x和n,确定配离子的组成。
经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol 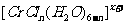 的溶液,与R-H完全交换后,中和生成的
的溶液,与R-H完全交换后,中和生成的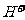 需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
[解析]答案


31从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
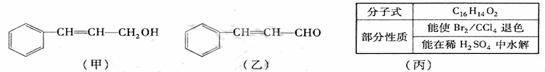
(1)甲中含氧官能团的名称为 。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
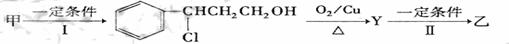
其中反应Ⅰ的反应类型为 ,反应Ⅱ的化学方程式为 (注明反应条件)。
(3) 已知
: 
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质量):

①下列物质不能与C反应的是 (选填序号)
a. 金属钠 b. 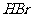 c.
c. 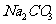 溶液 d. 乙酸
溶液 d. 乙酸
②写出F的结构简式 。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式 。
a. 苯环上连接着三种不同官能团 b. 能发生银镜反应
c.能与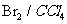 发生加成反应 d。遇
发生加成反应 d。遇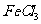 溶液显示特征颜色
溶液显示特征颜色
④综上分析,丙的结构简式为 。
[解析]答案:

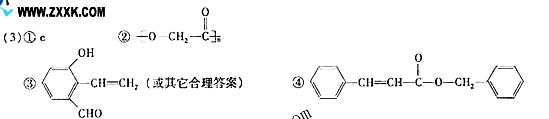
(1)很明显甲中含氧官能团的名称为羟基OH;
(2)甲在一定条件下双键断开变单键,应该发生加成反应;
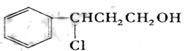 催化氧化生成Y为
催化氧化生成Y为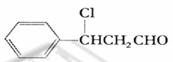 ;Y在强氧化钠的醇溶液中发生消去反应。
;Y在强氧化钠的醇溶液中发生消去反应。
(4) ①C的结构简式为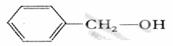 ,不能与碳酸钠反应
,不能与碳酸钠反应
②F通过E缩聚反应生成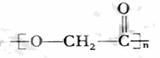
③D能发生银镜反应,含有醛基,能与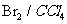 发生加成反应,说明含有不饱和双键;遇
发生加成反应,说明含有不饱和双键;遇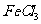 溶液显示特征颜色,属于酚。综合一下可以写出D的结构简式
溶液显示特征颜色,属于酚。综合一下可以写出D的结构简式
④丙是C和D通过酯化反应得到的产物,有上面得出C和D的结构简式,可以得到丙的式子
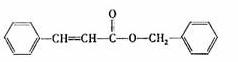
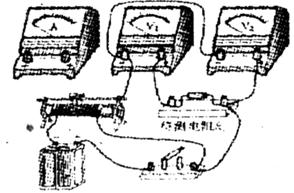
25. 工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除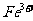 外还可能含有
外还可能含有 。若要确认其中的
。若要确认其中的 ,应先用
选填序号)。
,应先用
选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水
d.酸性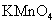 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
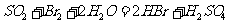
然后加入足量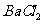 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中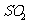 的体积分数为
。
的体积分数为
。
[探究二]
分析上述实验中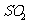 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有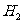 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
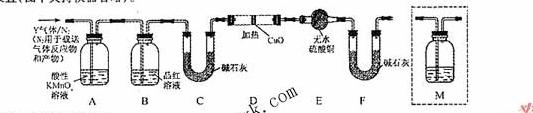
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有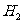 ,预计实验现象应是
。
,预计实验现象应是
。
(7)若要测定限定体积气体Y中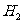 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml 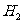 ),除可用测量
),除可用测量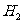 体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由
。
24. 硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3 MgO、CaO等,生产工艺流程示意如下:
(1) 将菱锌矿研磨成粉的目的是_____。
(2) 完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是_______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
|
|
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
开始沉淀的pH |
10.4 |
6.4 |
- |
- |
|
沉淀完全的pH |
12.4 |
8.0 |
- |
- |
|
开始溶解的pH |
- |
10.5 |
- |
- |
|
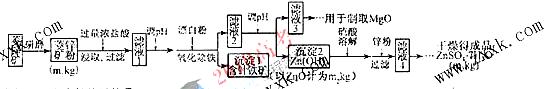
Ksp |
5.6×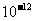 |
- |
6.8× |
2.8×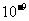 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
[解析]答案:


23.(15分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。 [来
[来
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。

12.化合物Bilirubin在一定波长的光照射下发生分解反应,反应物尝试随反应时间变化如右图所示,计算反应4~8 min间的平均反应速率和推测反应16 min 反应物的浓度,结果应是

11.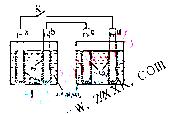 铅蓄电池的工作原理为:
铅蓄电池的工作原理为: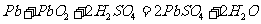 研读 右图,下列判断不正确的是
研读 右图,下列判断不正确的是
A. K 闭合时,d电极反应式:
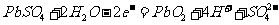
B. 当电路中转移0.2mol电子时,I中消耗的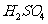 为0.2 mol
为0.2 mol
C. K闭合时,II中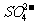 向c电极迁移
向c电极迁移
D. K闭合一段时间后,II可单独作为原电池,d电极为正极
[解析]答案:C
本题考查电化学(原电池、电解池)的相关知识
.K闭合时Ⅰ为电解池,Ⅱ为电解池,Ⅱ中发生充电反应,d电极为阳极发生氧化反应,其反应式为PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42- 所以A正确。在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,所以B对。K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,所以D也正确。K闭合时d是阳极,阴离子向阳极移动,所以C错。
10.下列关于电解质溶液的正确判断是
A. 在pH = 12的溶液中,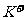 、
、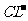 、
、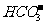 、
、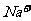 可以常量共存
可以常量共存
B. 在pH= 0的溶液中,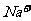 、
、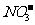 、
、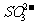 、
、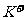 可以常量共存
可以常量共存
C. 由0.1 mol·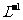 一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=
一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=
D. 由0.1 mol·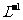 一元碱HA溶液的pH=3, 可推知NaA溶液存在A- + H2O⇋HA + OH-
一元碱HA溶液的pH=3, 可推知NaA溶液存在A- + H2O⇋HA + OH-
10[解析]答案:D
本题考查常见离子的共存、弱电解质溶液的电离和水解
A. pH=12的溶液呈碱性含有比较多的OH-,不能与HCO3-共存
B. pH=0的溶液呈酸性含有较多的H+,在NO3-离子存在的情况下,亚硫酸根离子容易被氧化成硫酸根离子,无法共存
C. 0.1mol/L的一元碱的pH=10表明该一元碱是弱碱,在溶液中不能完全电离
D. 由题意可得该酸是弱酸,在NaA溶液中A-会发生水解而使溶液呈碱性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com