
1.如图所示,竖直向下的匀强磁场穿过光滑的绝缘水平面,平面上一个钉子O固定一根细线,细线的另一端系一带电小球,小球在光滑水平面内绕O做匀速圆周运动.在某时刻细线断开,小球仍然在匀强磁场中做匀速圆周运动,下列说法一定错误的是
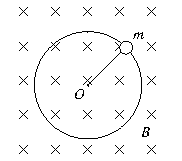
A.速率变小,半径变小,周期不变
B.速率不变,半径不变,周期不变
C.速率不变,半径变大,周期变大
D.速率不变,半径变小,周期变小
(二)(5)因此时容器的容积不变,而(1)中容器的容积缩小,(5)小题中容器相当于在(1)的基础上减压,则平衡逆向移动,故反应达到平衡后a>b,即应填(甲)。
[专题训练]
1、在t℃时,向2L密闭容器中放入1molA和1molB,发生下列反应:
A(g)+B(g)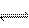 C(g)+2D(g),平衡时C的含量为m%,保持其他条件不变,若按下列配比将物质放入容器中达到平衡时,C的含量仍为m%的是
( )
C(g)+2D(g),平衡时C的含量为m%,保持其他条件不变,若按下列配比将物质放入容器中达到平衡时,C的含量仍为m%的是
( )
A.2molA和1molB B.2molD和A、B、C各1mol
C.1molC和2molD D.1molC和1molD
2、在一定温度下,把2mol SO2和1mol O2通入一个一定容积的密闭容器里,发生如下反应:2SO2 +O2 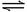 2 SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保持达到平衡时,反应混合物中三种气体的体积分数仍和上述平衡时的完全相同。请填写下列空白:
2 SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始加入的SO2、O2和SO3的物质的量(mol)。如a、b、c取不同的数值,它们必须满足一定的相互关系,才能保持达到平衡时,反应混合物中三种气体的体积分数仍和上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c= _____________。
(2)若a=0.5,则b= _________ 和c= __________。
(3)a、b、c必须满足的一般条件是(请用两个方程式表示,其中一个只含a和c,另一个只含b和c): __________________________________________________。
3、在一个固定体积的密闭容器中,加入2mol A和1mol B,发生反应:
2A(g)+B(g)
 3C(g)+D(g) 达平衡时,c (C)=W mol/L。若维持容器内体积和温度不变,按下列四种配比作起始物质,达平衡后,C浓度仍为W mol/L的是( )
3C(g)+D(g) 达平衡时,c (C)=W mol/L。若维持容器内体积和温度不变,按下列四种配比作起始物质,达平衡后,C浓度仍为W mol/L的是( )
A.1mol A+0.5mol B+1.5mol C+0.5 D
B.2mol A+1mol B+3mol C+1mol D
C.3mol C+1mol D+1mol B
D.3mol C+1mol D
4、在一恒温恒容密闭容器中,A、B气体可建立如下平衡:
2A(g)+2B(g)  C(g)+3D(g)
C(g)+3D(g)
现分别从两条途径建立平衡:
I.A、B的起始量均为2mol;
Ⅱ.C、D的起始量分别为2mol和6mol。
下列叙述不正确的是: ( )
A.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.I、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成不同
C.达到平衡时,途径I的 和途径Ⅱ体系内混合气体平均相对分子质量相同
D.达到平衡时,途径I的气体密度为途径Ⅱ密度的1/2
5、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
2A(g)+2B(g) 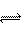 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为1.2mol/L,C的体积分数为a% 。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是 ( )
A.3mol C+1mol D B.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol C D.4mol A+2mol B
6、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气)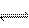 xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为 ( )
xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为 ( )
A.1 B.2 C.3 D.4
7、在一个1L的密闭 容器中,加入2molA和1molB ,发生下述反应:
容器中,加入2molA和1molB ,发生下述反应:
2A(g)+B(g) 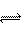 3C(g)+D(g)
3C(g)+D(g)
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L(或C的体积分数仍是a%)的是 ( )
A.3mol C+1mol D B.1mol A+0.5mol B+1.5mol C+0.5mol D
C.1mol A+0.5mol B+1.5mol C D.4mol A+2mol B
8、在恒温、恒压的条件下,向可变容积的密闭容器中充入3LA和2LB,发生如下反应:
3A(气)+2B(气)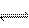 xC(气)+yD(气)
xC(气)+yD(气)
达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA 、0.4LB.4LC.0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则X、Y的值分别为( )
A.x=3 y=1
B.x=4 y=1 
C.x=5 y =1  D.x=10 y=2
D.x=10 y=2
9、在一个容积固定的密闭容器中充入1molHI,建立如下平衡:H2(g)+I2 (g)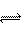 2HI(g),测得HI的转化率为a%。其他条件不变,在上述平衡体系中再充入1molHI,待平衡建立时HI的转化率为b%,则a、b的关系为
( )
2HI(g),测得HI的转化率为a%。其他条件不变,在上述平衡体系中再充入1molHI,待平衡建立时HI的转化率为b%,则a、b的关系为
( )
A.a>b B.a<b C.a=b D.无法确定
10、一个真空密闭恒容容器中盛有1molPCl5,加热到200℃发生如下反应:
PCl5(g)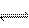 PCl3(g)+Cl2(g),反应达到平衡时,混合气体中PCl5,所占体积分数为M%,。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5,所占体积分数为N%。则M和N的关系是
( )
PCl3(g)+Cl2(g),反应达到平衡时,混合气体中PCl5,所占体积分数为M%,。若同一温度的同一容器中,最初投入2 molPCl5,反应达平衡时,混合气体中PCl5,所占体积分数为N%。则M和N的关系是
( )
A. M>N B.M=N C.M < N D.无法确定
11、已知甲为恒温恒压容器,乙为恒温恒容容器。两容器中均充入2mol SO2、1mol O2,初始时两容器的温度体积相同。一段时间后反应达到平衡,为使两容器中的SO2在平衡混合物的物质的量分数相同,下列措施中可行的是 ( )
A.向甲容器中充入一定量的氦气
B.向乙容器中充入一定量的SO3气体
C.升高乙容器的温度
D.增大甲容器的压强
12、有两个密闭容器A和B,A容器内有一个移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等量的体积比为2:1的SO2和O2的混合气体,并使A和B的容积相等。
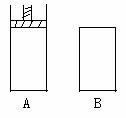
在保持4000C的条件下使之发生如下反应:2 SO2+O2 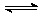 2SO3。
2SO3。
(1)达到平衡时所需要的时间A容器比B容器 ,A容器中SO2的转化率比B容器 。
(2)达到(1)所述平衡后,若向两容器中通入数量不多的等量氩气,A容器化学平衡 移动,B容器化学平衡 移动。
(3)达到(1)所述平衡后,若向两容器中通入等量的原反应气体,达到平衡时,A容器SO3物质的量分数 ;B容器中SO3的物质的量分数 。(填增大、减小、不变)

12.(1)短、大
(2)逆向、不
(3)不变、增大
(二)若维持温度不变,在一个与(一)反应前起始体积相同,且容积固定的容器中发生 上述反应。
上述反应。
(5)开始时放入1mol A和1mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较__________(填编号)。
(甲)a>b
(乙)a<b
(丙)a=b
(丁)不能比较a和b的大小
作出此判断的理由是____________。
解析:(一)(1)由反应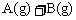

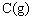 知,反应达平衡后,若有a mol C生成,则必有a mol A物质消耗,此时剩余A的物质的量为(1-a)mol。
知,反应达平衡后,若有a mol C生成,则必有a mol A物质消耗,此时剩余A的物质的量为(1-a)mol。
(2)在恒温、恒压下,若投放3mol A和3mol B,则所占有的体积为(1)中的3倍。由于A、B的投放比例与(1)相同,故平衡时与(1)等效,而C的物质的量为3a mol。
(3)由于达到平衡时C的物质的量为3a mol,故此平衡状态与(2)完全相同。若把C的物质的量完全转化为A和B,A、B的物质的量应与(2)完全相等。
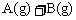

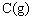
起始(mol):  x 2 1
x 2 1
将C转化为A、B(mol): x+1 2+1 0
平衡时(mol): y 3-3a 3a
据题意有: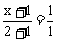 ,解得
,解得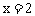 ;
;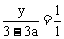 ,解得y=3-3a。
,解得y=3-3a。
通过上述可知,平衡时B的物质的量为(3-3a)mol,由于该反应起始时投放的物质为A、B、C均有,即从中间状态开始达到平衡,故平衡可能向左、向右或不移动,也即3a可能大于、小于或等于1(不移动时,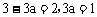 ),故(3)中B的物质的量应为(丁)。
),故(3)中B的物质的量应为(丁)。
(4)在(3)的平衡中,再加入3mol C,所达到的平衡状态与(1)、(2)、(3)皆为等效状态,通过(1)可求出C的物质的量分数为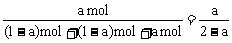 ,也就是在(3)的平衡状态时C的物质的量分数。
,也就是在(3)的平衡状态时C的物质的量分数。
我们常采用“等价转换”的方法,分析和解决等效平衡问题。
1. 在定温、定容条件下,对于化学 反应前后气体分子数改变的可逆反应,只改变起始加入物质的物质的量,如果通过可逆反应的化学计量数之比换算成化学方程式的同一边物质的物质的量与原平衡相同,则两平衡等效。
反应前后气体分子数改变的可逆反应,只改变起始加入物质的物质的量,如果通过可逆反应的化学计量数之比换算成化学方程式的同一边物质的物质的量与原平衡相同,则两平衡等效。
2. 在定温、定容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量之比与原平衡相同,则两平衡等效。
3. 在定温、定压条件下,改变起始时加入物质的物质的量,只要按化学计量数之比换算成化学方程式的同一边物质的物质的量之比与原平衡相同,达到平衡状态后与原平衡等效。
[题型解读]
题型1:一般可逆反应在恒温、恒容条件下建立等效平衡
例1、在一个体积固定的密闭容器中加入2 mol A和1 mol B,发生反应:
2A(g)+B(g) 3C(g)+D(g),达到平衡时C的浓度为a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是( )
3C(g)+D(g),达到平衡时C的浓度为a mol·L-1。若维持容器体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍为a mol·L-1的是( )
A.4molA+2molB
B.2molA+1molB+3molC+1molD
C.3molC+1molD+1molB
D.3molC+1molD
分析:等效平衡的含义:在一定条件(恒温恒容或恒温恒压)下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的百分含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称等效平衡。
对于一般可逆反应,在恒 温恒容条件下,只改变起始加入的情况,只要通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
温恒容条件下,只改变起始加入的情况,只要通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
假设2 mol A和1 mol B能够完全反应,则应生成3molC+1molD,所以如果维持容器体积和温度不变,开始时向容器中加入3molC+1molD,达到平衡时,与原平衡是等效平衡,则C的浓度仍为a mol·L-1。
答案:D。
题型2:反应前后气体体积不变的可逆反应在恒温、恒容条件下建立等效平衡
例2、可逆反应A(g)+B(g) 2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1mol C,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的是( )
2C(g)在固定容积的容器中进行,如果向容器中充入1mol A和1mol B,在某温度下达到平衡时,C的体积分数为m%;若向容器中充入1mol C,在同样的温度下达到平衡时,C的体积分数为n%,则m和n的关系正确的是( )
A.m>n B.m<n C.m=n D.无法比较
 答案:C。
答案:C。
题型3:可逆反应在恒温、恒压条件下建立等效平衡
例3、在一个盛有催化剂容积可变的密闭容器中,保持一定温度和压 强,进行以下反应:
强,进行以下反应:
N2+3H2 2NH3。已知加入1mol N2和4mol H2时,达到平衡后生成a mol NH3(见下表已知项)。在相同温度、压强下,保持平衡时各组分的体
2NH3。已知加入1mol N2和4mol H2时,达到平衡后生成a mol NH3(见下表已知项)。在相同温度、压强下,保持平衡时各组分的体 积分数不变。对下列编号①-③的状态,填写表中空白。
积分数不变。对下列编号①-③的状态,填写表中空白。
|
已知 编号 |
起始状态物质的量
n/mol |
平衡时NH3的物质的量 n/mol |
||
|
N2 |
H2 |
NH3 |
||
|
1 |
4 |
0 |
a |
|
|
① |
1.5 |
6 |
0 |
|
|
② |
|
|
1 |
0.5a |
|
③ |
m |
g(g≥4m) |
|
|
分析:对于一般的可逆反应,在恒温恒压条件下,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达平衡后,与原平衡等效。
①因为从题干可知n(N2)∶n(H2)∶n(NH3)平衡=1∶4∶a,所以①状态下n(N2)∶n(H2)∶n(NH3)平衡=1.5∶6∶1.5a。
②起始状态时,有1mol NH3,则相当于起始时有N2和H2分别为0.5mol和1.5mol,按n(N2)∶n(H2)∶n(NH3)平衡=1∶4∶a,可得②状态时n(N2)∶n(H2)∶n(NH3)平衡=0.5∶2∶0.5a,所以原有N2和H2分别为0和0.5mol。
③设起始时n(NH3)为x mol,则相当于N2和H2总量分别为(m+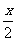 )mol和(g+
)mol和(g+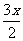 )mol,则(m+
)mol,则(m+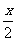 )∶(g+
)∶(g+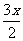 )=1∶4,即可得x=2(g-4m)
)=1∶4,即可得x=2(g-4m)
设为n(NH3)平衡y mol,可得:
4∶a=(g+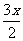 )∶y,即:y=(g-3m)·a。
)∶y,即:y=(g-3m)·a。
题型4:通过建立等效平衡的中间状态,比较反应物转化率的大小以及平衡时某物质体积分数、浓度的大小
例4、体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
A.等于p% B.大于p% C.小于p% D.无法判断
分析:根据题意,甲、乙两容器可设为如图所示装置。

2SO2+O2 2SO3是一气体总物质的量减少的反应。甲容器保持体积不变,压强变小;乙容器保持压强不变,体积减小,达到平衡状态时转化为状态丙。假设乙中的活塞不移动,由于甲、乙两个容器的体积、温度相同,达到平衡时甲、乙两容器中存在的平衡是等效平衡,其中SO2的转化率也相等。对于乙和丙两个状态,乙中压强小于丙中压强,因此丙中SO2转化率大于乙中SO2转化率。由此可以判断出丙中SO2的转化率也大于甲中SO2的转化率。所以正确答案为B。
2SO3是一气体总物质的量减少的反应。甲容器保持体积不变,压强变小;乙容器保持压强不变,体积减小,达到平衡状态时转化为状态丙。假设乙中的活塞不移动,由于甲、乙两个容器的体积、温度相同,达到平衡时甲、乙两容器中存在的平衡是等效平衡,其中SO2的转化率也相等。对于乙和丙两个状态,乙中压强小于丙中压强,因此丙中SO2转化率大于乙中SO2转化率。由此可以判断出丙中SO2的转化率也大于甲中SO2的转化率。所以正确答案为B。
[规律总结]对于气体参加的可逆反应,在温度恒定 的条件下,涉及体积与压强以及平衡移动有关判断的问题时,可设计一些等效平衡的中间状态来进行求解。这样能降低思维难度,具有变难为易、变抽象为直观的作用。
的条件下,涉及体积与压强以及平衡移动有关判断的问题时,可设计一些等效平衡的中间状态来进行求解。这样能降低思维难度,具有变难为易、变抽象为直观的作用。
[高考在线]
例1:在一定温度下,把2mol SO2和1mol O2通入一定容积的密闭容器中, 发生如下反应,
发生如下反应,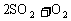

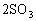 ,当此反应进行到一定程度时反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始时加入的
,当此反应进行到一定程度时反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始时加入的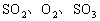 的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。请填空:
的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。请填空:
(1)若a=0,b=0,则c=___________。
(2)若a=0.5,则b=___________,c=___________。
(3)a、b、c的取值必须满足的一般条件是___________,___________。(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)
 (即等价转换),恰好跟反应从2mol SO2和1mol O2的混合物开始是等效的,故c=2。
(即等价转换),恰好跟反应从2mol SO2和1mol O2的混合物开始是等效的,故c=2。
(2)由于a=0.5<2,这表示反应从正、逆反应同时开始,通过化学方程式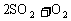

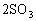 可以看出,要使0.5 mol SO2反应需要同时加入0.25mol O2才能进行,通过反应的化学计量数之比换算成SO3的物质的量(即等价转换)与0.5 mol SO3是等效的,这时若再加入1.5 mol SO3就与起始时加入2 mol SO3是等效的,通过等价转换可知也与起始时加入2 mol SO2和1mol O2是等效的。故b=0.25,c=1.5。
可以看出,要使0.5 mol SO2反应需要同时加入0.25mol O2才能进行,通过反应的化学计量数之比换算成SO3的物质的量(即等价转换)与0.5 mol SO3是等效的,这时若再加入1.5 mol SO3就与起始时加入2 mol SO3是等效的,通过等价转换可知也与起始时加入2 mol SO2和1mol O2是等效的。故b=0.25,c=1.5。
(3)题中要求2mol
SO2和1mol O2要与a mol SO2、b mol O2和c mol SO3建立等效平衡。由化学方程式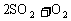

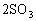 可知,c mol SO3等价转换后与c mol SO2和
可知,c mol SO3等价转换后与c mol SO2和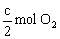 等效,即是说,
等效,即是说,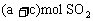 和
和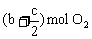 与a mol SO2、b mol O2和c mol SO3等效,那么也就是与2mol SO2和1mol O2等效。故有
与a mol SO2、b mol O2和c mol SO3等效,那么也就是与2mol SO2和1mol O2等效。故有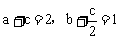 。
。
例 2:在一个固定容积的密闭容器中,保持一定的温度进行以下反应:
2:在一个固定容积的密闭容器中,保持一定的温度进行以下反应:
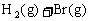

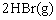
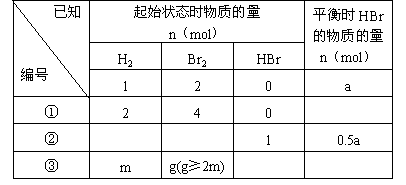
已知加入1mol H2和2mol Br2时,达到平衡后生成a mol HBr(见下表已知项),在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①-③的状态,填写下表中的空白。
解析:在定温、定容下,

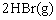 建立起化学平衡状态,从化学方程式可以看出,这是一个化学反应前后气体分子数相等的可逆反应。根据“等价转换”法,通过反应的化学计量数之比换算成同一边物质的物
建立起化学平衡状态,从化学方程式可以看出,这是一个化学反应前后气体分子数相等的可逆反应。根据“等价转换”法,通过反应的化学计量数之比换算成同一边物质的物 质的量之比与原平衡相同,则达到平衡后与原平衡等效。
质的量之比与原平衡相同,则达到平衡后与原平衡等效。
①因为标准项中n(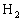 起始):n(
起始):n(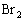 起始):n(HBr平衡)=1:2:a,将n(H2起始)=2mol,n(Br2起始)=4mol,代入上式得n(HBr平衡)=2a。
起始):n(HBr平衡)=1:2:a,将n(H2起始)=2mol,n(Br2起始)=4mol,代入上式得n(HBr平衡)=2a。
②参照标准项可知,n(HBr平衡)=0.5a mol,需要n(H2起始)=0.5mol,n(Br2起始)=1mol,n(HBr起始)=0mol。而现在的起始状态,已有1mol HBr,通过等价转换以后,就相当于起始时有0.5 mol H2和0.5 mol Br2的混合物,为使n(H2起始):n(Br2起始)=1:2,则需要再加入0.5 mol Br2就可以达到了。故起始时H2和Br2的物质的量应为0mol和0.5mol。
③设起始时HBr的物质的量为x mol,转换成H2和Br2后,则H2和Br2的总量分别为(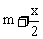 )mol和(
)mol和(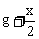 )mol,根据
)mol,根据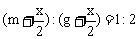 ,解得
,解得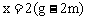 。设平衡时HBr的物质的量为y mol,则有
。设平衡时HBr的物质的量为y mol,则有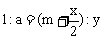 ,解得
,解得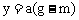 。
。
例3:如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应: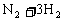

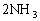 (正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:
(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:

(1)保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:
①若a =1,c=2,则b=_________。在此情况下,反应起始时将向_________(填“正”或“逆”)反应方向进行。
=1,c=2,则b=_________。在此情况下,反应起始时将向_________(填“正”或“逆”)反应方向进行。
②若需规定起始时反应向逆反应方向进行,则c的取值范围是_________。
(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是_________,原因是_________。
 因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,由差量法可解出平衡时
因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,由差量法可解出平衡时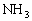 为1体积;而在起始时,
为1体积;而在起始时,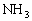 的体积为c=2体积,比平衡状态时大,为达到同一平衡状态,
的体积为c=2体积,比平衡状态时大,为达到同一平衡状态,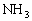 的体积必须减小,所以平衡逆向移动。
的体积必须减小,所以平衡逆向移动。
②若需让反应逆向进行,由上述①所求出的平衡时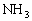 的体积为1可知,
的体积为1可知,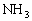 的体积必须大于1,最大值则为2体积
的体积必须大于1,最大值则为2体积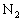 和6体积
和6体积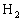 完全反应时产生的
完全反应时产生的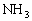 的体积,即为4体积,则
的体积,即为4体积,则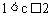 。
。
(2)由6.5<7可知,上述平衡应向体积缩小的方向移动,亦即向放热方向移动,所以采取降温措施。
例4:(一)恒温、恒压下,在一个容积可变的容器中发生如下反应:
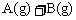

(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为________ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为_________mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x=________,y=________。平衡时,B的物质的量________(填编号)。
(甲)大于2mol
(乙)等于2mol
(丙)小于2mol
(丁)可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是___________。
2. 定温、定压条件下的等效平衡。
在等效平衡中比较常见并且重要的类型主要有以下几种:
1. 定温、定容条件下的等效平衡:
①化学反应前后气体分子数改变的等效平衡。
②化学反应前后气体分子数不变的等效平衡。
我们所说的“等效平衡”与“完全相同的平衡状态”不同;“完全相同的平衡状态”在达到平衡状态时,任何组分的物质的量分数(或体积分数)对应相等,并且反应的速率等也相同;而“等效平衡”只要求平衡混合物中各组分的物质的量分数(或体积分数)对应相同,反应的速率、压强等可以不同。
24.(10分)X、Y、Z三种短周期元素,它们的原子序数之和 为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:

已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极 均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4) 已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
 b.反应过程中,Y的单质的体积分数始终为50%
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程 中,混合气体平均相对分子质量减小
中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
23.(12分)某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
|
编号 |
电极材料 |
电解质溶液 |
电流指针偏转方向 |
|
1 |
Mg Al |
稀盐酸 |
偏向Al |
|
2 |
Al Cu |
稀盐酸 |
偏向Cu |
|
3 |
Al 石墨 |
稀盐酸 |
偏向石墨 |
|
4 |
Mg Al |
NaOH溶液 |
偏向Mg |
|
5 |
Al Zn |
浓硝酸 |
偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?____________。
(2)写出实验3中的电极反应式。
铝为( )_____________________________________;
石墨为( )___________________________________;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式。
(4)解释实验5中电流指针偏向铝的原因。
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
22.(8分)A是一种气态烃。B和D是生活中两种常见的有机物。以A为主要原料合成乙酸乙酯,其合成路线如下图所示:
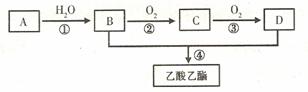
(1)A的结构式为_____________
(2)A-→B的反应类型为
(3)D的水溶液与氢氧化钠反应的离子方程式为
(4)B与钠反应的化学方程式为____________________
(5)反应④的化学反应方程式为:________________ ____
____
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com