
11.(2009·苏州模拟)关于第ⅥA族和第ⅦA族元素的下列说法中正确的是( )
A.在同一周期,第ⅥA族元素氢化物的稳定性比第ⅦA族的强
B.浓度都是0.01 mol/L时,硫酸溶液的pH比高氯酸溶液的小
C.第ⅦA族单质的氧化性均比第ⅥA族单质的氧化性强
D.加热时,硫酸钠比氯酸钠易分解
解析 A项,同周期元素,第ⅦA族形成的氢化物最稳定,因为同周期元素的非金属性 第ⅦA族最强,A项错误;B项,H2SO4为二元酸,HClO4为一元酸,所以同浓度溶液 H2SO4中c(H+)大,pH小,B项正确;C项,如I2的氧化性比O2弱,C项错误;D项, Na2SO4比NaClO3稳定,D项错误。
答案 B
10.(2010·济南调研)下列现象或事实可用同一原理解释的是 ( )
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.氯水和活性炭使红墨水褪色
C.漂白粉和水玻璃长期暴露在空气中变质
D.乙炔和乙烯使溴的四氯化碳溶液褪色
解析 A中浓H2SO4是吸水而浓HCl易挥发,故原理不同;B项中氯水中HClO表现强 氧化性,而活性炭是吸附作用;C项中漂白粉变质是先与空气中CO2反应生成HClO, HClO又分解才失效,而水玻璃(Na2SiO3)与空气中CO2反应后即失效,原理不同, 故错 误;D项中都是加成反应,原理相同。
答案 D
9.(2010·南京模拟)短周期元素E的氯化物ECln的熔点为-78℃,沸点为59℃;若0.2 mol ECln与足量的AgNO3溶液完全反应后可以得到57.4 g的AgCl沉淀。下列判断错误的是 ( )
A.E是一种非金属元素
B.在ECln中E与Cl之间形成共价键
C.E的一种氧化物为EO2
D.E位于元素周期表的ⅡA族
解析 0.2 mol ECln与足量AgNO3溶液完全反应生成57.4 g AgCl沉淀,因此根据Ag+的 物质的量与Cl-相等列式:0.2 mol·n=
解得:n=2,则E的氯化物质为ECl2,再结合ECl2的熔、沸点较低,可知ECl2为分子 晶体,则E为非金属元素,不可能在ⅡA族,因此A、B、C正确,只有D错误。
答案 D
8.(2009·江苏盐城中学模拟)对某酸性溶液(可能含有Br-,SO,H2SO3,NH)分别进 行如下实验:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是 ( )
A.Br- B.SO C.H2SO3 D.NH
解析 ①加热时放出的气体可以使品红溶液褪色,则溶液中一定含有H2SO3,因H2SO3 不稳定,分解产生的SO2可使品红溶液褪色。②加碱加热后,产生使润湿的红色石蕊试 纸变蓝的气体即有NH3产生,说明溶液中一定含有NH。③加入氯水时溶液显黄色,说 明原溶液中含有Br-,再加BaCl2有白色不溶于HNO3的沉淀生成,说明此时溶液中含 SO,但可能是原溶液含有的,也可能是氯水氧化H2SO3产生的,故不能确定的为SO。
答案 B
7.(2010·崇文区模拟)在如图的实验装置中,实验开始一段时间后,对看到的现象叙述不 正确的是 ( )
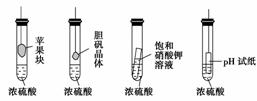
A.苹果块会干瘪 B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出 D.pH试纸变红
解析 浓H2SO4具有吸水性和脱水性,前三个实验中显示浓H2SO4的吸水性,现象均正 确;最后一个实验主要体现浓H2SO4的酸性和脱水性,pH试纸应先变红后变黑。
答案 D
6.(2009·广州模拟)2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓 好节能降耗、保护环境”,下列举措与这一主题不吻合的是 ( )
A.用“绿色化学”工艺,使原料完全转化为产物
B.推广燃煤脱硫技术,防治SO2污染
C.推广垃圾的分类存放、回收、处理
D.大量使用农药化肥提高粮食产量
答案 D
5.(2010·金华一中期中)下列说法中错误的是 ( )
A.二氧化硫能漂白某些物质,说明它具有氧化性
B.二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5 mL 3%的过氧化氢后产生沉淀
C.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性
D.二氧化硫漂白过的草帽过一段时间后变黄
解析 SO2的漂白原理是:SO2与有色物质生成不稳定的无色物质而具有漂白性,故A 说法错误。
答案 A
4.(2008·上海理科综合,15)1995年三位美国科学家因在氟利昂和臭氧层方面的工作获 得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,由图可知( )
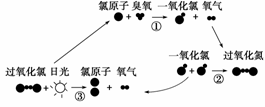
A.日光在反应中作催化剂
B.过氧化氯是一种很稳定的物质
C.过氧化氯的结构式为O-Cl-Cl-O
D.臭氧分子最终转变成氧气分子
解析 由图中反应的转化关系可知过氧化氯在日光下分解,因此并不是很稳定物质,过 氧化氯的结构式应为Cl-O-O-Cl,因此A、B、C选项都不正确,只有D正确。
答案 D
3.(2009·山东理综,13)下列推断合理的是 ( )
A.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C.浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加 热也能恢复原色
解析 KAl(SO4)2·12H2O电离出的Al3+能水解,生成Al(OH)3胶体,可用作净水剂,A 正确;金刚石能够与氧气发生反应,生成二氧化碳,B错误;浓H2SO4有强氧化性,在 加热条件下与Cu可剧烈反应,C错误;SO2使品红溶液褪色,加热颜色能复原;SO2和 溴水发生氧化还原反应,加热不能恢复原来颜色,D错误。
答案 A
2.(2009·北京理综,8)下列叙述正确的是 ( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变
解析 CO2和SO2通入BaCl2溶液中均不会产生沉淀,A错误;在酸性条件下,NO可 将Cu氧化生成Cu2+,使铜粉溶解,B错误;NH3·H2O是Al3+的良好沉淀剂,而NaHSO4 显强酸性,可使Al(OH)3溶解,C正确;在Zn和稀H2SO4的反应体系中加CuSO4,会 形成Cu-Zn原电池而加快H2的产生速率。
答案 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com