
39.(26分)
(1)莫斯科保卫战是德军在二战中遭受的第一次重大失败,宣告德军“闪电战”的破产;
斯大林格勒战役不仅使苏德战场局势发生根本转折,而且对推动整个反法西斯战局的变化也
具有深远的影响;库尔斯克会战使德国失去了苏德战场的主动权;苏军攻克柏林,德国无条件投降;对日宣战,加速了日本的投降。(8分,答对4项即得满分。)
(2)美国海军的绝对优势;苏联红军出兵中国东北;美国投放原子弹;综合因素作用的结果。(3分,任意三点3分) 不全面。(1分) 忽视了中华民族全民族抗战的作用。(具体列举史实说明的同样赋分)(2分)
(3)抗日战争胜利提高了中国国际地位,增强了中国人民的自尊心和自信心,为民主革命在全国的胜利奠定基础。(6分)
(4)各国政府通过官方渠道建立联合国, 有力地制约着战争;战后世界人民反战意识强烈, 反战和平运动不断高涨;发展世界经济,促进经济全球化程度不断加深和世界多极化,有利于制止战争。(6分)
38.(26分)
(1)不夺农时,推行均田制,轻徭薄赋。(3分)
(2)国外:欧美资本主义国家贫富分化严重,社会矛盾尖锐。(2分)
国内:地主垄断土地,农民生活贫困。(2分)
具体主张:平均地权,节制资本,扶助农工。 (4分)
(3)体现:打土豪,分田地,废除封建剥削制度。(4分)
(4)内容:发展社会经济;减少财政(军费)开支;制止通货膨胀;稳定社会消费能力;扩大社会保障(福利)。(5分)
作用:实现了战时经济向和平经济转轨;促进社会经济发展,改善人民生活,缓和社会矛盾;确保美国资本主义世界头号强国地位并为推行全球扩张战略创造有利条件。(4分)
(5)人民享有自由、平等和人权;提高人民的物质和文化水平;每个人都享有全面发展的机会。(任意两个答案,总分2分)
37.(26分)
(1)小城镇迅速发展;城市数目急剧增加。(6分)
(2)原因:劳动力成本上升,土地价格增加(或土地资源限制),政策调整(或旧城改造)等。特点:迁移与关停的的企业主要是传统的劳动力指向型企业,迁移企业的去向集中在广东省内其他经济相对不发达地区。(每点2分,共10分,言之有理也可酌情给分。)
(3)应该发展中心城市,将中心城市定位在“自主创新”和“高端服务业”性质的城市;(4分)其产业主要是发展“试制品研发或开发”与“售后服务”上;把加工组装企业转移到相对落后的地区。(6分)
36.(30分)
(1)东段和西段:东西走向,中段:南北走向。原因:海陆热力性质差异,冬季同纬度海水温度高于陆地温度;受北大西洋暖流影响,海水温度升高。(8分)
(2)森林(温带落叶阔叶林) 草原(温带草原) 干湿度地带分异规律 降水自西向东递减(水分条件差异) (8分)
(3)热带雨林 北部处于来自海洋的东北信风的迎风坡,附近海域有暖流流经,加上地形的抬升作用,形成地形雨。
(4)热带种植园农业 有利条件:纬度低,光热充足,适宜农作物的生长;沿海和有
沿河有狭窄平原,地形平坦,土壤肥沃。不利条件:飓风侵袭,风力强盛,洪水泛滥,农业受损严重。(8分)
16.(12分)(探究创新)已知有机色质的发色官能团可以被氧化或发生加成反应生成无色 物质。
(1)为了探索比较SO2和Cl2的漂白原理,甲同学做了如下对比实验:
______.将干燥的SO2和干燥的Cl2分别通到干燥的品红试纸上,发现红色试纸均不褪色;
b.将SO2和Cl2分别通入品红溶液中,发现品红溶液均褪色;
c.加热b中漂白后的溶液,发现前者恢复红色,并产生刺激性气体,后者不能;
d.将SO2和Cl2分别持续通入紫色石蕊试液中,发现前者只变红,不褪色,后者先变红, 后褪色。
请根据甲同学的实验事实,简要说明SO2与Cl2的漂白原理相同与不同之处。
①相同之处:SO2和Cl2本身都没有漂白性,起漂白作用的分别是与水反应后的产物 ________和________。
②不同之处:H2SO3只能与某些有机色质发生______反应,生成不稳定的无色物质,产 物受热分解再放出SO2,是非氧化还原反应。HClO能与很多有机色质发生________反 应,生成物较稳定。
(2)乙同学为了探索对比O3、H2O2和Cl2的漂白能力大小,将等体积等浓度的品红溶液与 三种漂白剂呈喷雾状分别反应,至完全褪色时,发现消耗三种漂白剂的物质的量相同, 但褪色时间O3最短,H2O2次之,Cl2最长。
③消耗三种漂白剂的物质的量相同的原因是:每摩尔物质__________相等。
① O3漂白速度较H2O2快的主要原因是
________________________________________________________________________;
Cl2漂白速度最慢的主要原因可能是
________________________________________________________________________
________________________________________________________________________。
(3)丙同学为了比较H2O2和NaClO的氧化性强弱,将两者混合,观察到产生大量
无色无味气体。
② 丙同学认为,发生反应的离子方程式为
________________________________________________________________________
________________________________________________________________________,
由此确认NaClO的氧化性强于H2O2;丁同学认为产生气体也可能是H2O2分解的原因,
建议丙同学进一步补充实验来确认。补充实验需要的试剂是____________和
____________。
答案 ①H2SO3 HClO ②加成 氧化还原 ③得电子数 ④氧化性O3>H2O2 Cl2 与H2O反应生成HClO浓度较小 ⑤H2O2+ClO-===Cl-+H2O+O2↑ AgNO3溶液 稀HNO3
15.(12分)(2009·徐州检测)某课外活动小组的同学,在实验室做锌与浓硫酸反应的实验 中,甲同学认为产生的气体是二氧化硫,而乙同学认为除二氧化硫气体外,还可能产生 氢气。为了验证甲、乙两位同学的判断是否正确,丙同学设计了如图所示实验装置(锌与 浓硫酸共热时产生的气体为X,且该装置略去);试回答:
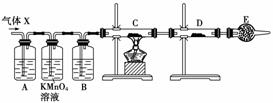
(1) 上述反应中生成二氧化硫的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2) 乙同学认为还可能产生氢气的理由是
________________________________________________________________________
________________________________________________________________________。
(3) 丙同学在安装好装置后,必不可少的一步操作是
________________________________________________________________________
________________________。
(4) A中加入的试剂可能是________,作用是
________________________________________________________________________;
B中加入的试剂可能是________,作用是
________________________________________________________________________;
E中加入的试剂可能是________,作用是
________________________________________________________________________。
(5)可以证明气体X中含有氢气的实验现象是:
C中:________________________,D中:
________________________________________________________________________。
如果去掉装置B,还能否根据D中的现象判断气体X中有氢气?________(填“能”或 “不能”),原因是
________________________________________________________________________
________________________________________________________________________。
解析 本题对Zn与浓H2SO4反应的产物进行两种推测,而后设计装置进行验证。设计 时既要验证有无SO2生成,又要验证有无H2生成。验证SO2,可用品红溶液,验证H2 可利用它的还原性,在加热条件下让气体通过CuO,再通过无水硫酸铜,同时必须注意 验证H2时,应考虑空气中的水蒸气和从洗气装置中带出的水蒸气对氢气检验的干扰。
答案 (1)Zn+2H2SO4(浓)ZnSO4+SO2↑+2H2O
(2)当Zn与浓H2SO4反应时,浓H2SO4浓度逐渐变稀,Zn与稀H2SO4反应可产生H2
(3)检查装置的气密性
(4)品红溶液 检验SO2 浓H2SO4 吸收水蒸气 碱石灰 防止空气中水蒸气进入D中
(5)黑色(CuO)变成红色(Cu) 白色粉末变成蓝色 不能 因为混合气体中可能含H2O, 会干扰H2的检验
14.(8分)(2010·长春调研)小刚同学探究二氧化硫分别与BaCl2溶液、Ba(OH)2溶液反应 的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________,
过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为
________________________________________________________________________。
(2)请回答有关问题。小刚同学将SO2通入到BaCl2溶液中,出现了异常现象,看 到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
则操作①的名称为__________,试剂A的化学式为
________________________________________________________________________。
(3)实验表明,小刚加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是________(填 化学式),产生该白色沉淀的离子方程式是
________________________________________________________________________。
解析 (1)SO2为酸性氧化物,通入碱溶液中生成相应的盐和水,SO2+
Ba(OH)2===BaSO3↓+H2O;通入过量SO2时,由于H2SO3为二元弱酸,所以得到酸式
盐,Ba(HSO3)2为强电解质,在溶液中以Ba2+、HSO形式存在,离子方程式为SO2+
OH-===HSO。
(2)固体、液体分离用过滤。SO2通入溶液中可能被O2氧化。猜测白色沉淀可能为 BaSO3或BaSO4,故试剂A选盐酸,为避免产生其他离子的影响,不能选H2SO4或HNO3。
(3)BaSO4不溶于盐酸。考虑空气中的O2将SO2氧化,2SO2+2Ba2++O2+
2H2O===2BaSO4↓+4H+。
答案 (1)SO2+Ba2++2OH-===BaSO3↓+H2O
SO2+OH-===HSO
(2)过滤 HCl
(3)BaSO4 2SO2+2Ba2++O2+2H2O===2BaSO4↓+4H+
1.5y 1.5y
NH+OH- === NH3+H2O
1 1
50c×10-3-1.5y 50c×10-3-1.5y
n(NH3)=50c×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136 mol
m(NH3)=0.136×17=2.31 g
答案 (1)FeS2
(2)2SO2+O2催化剂△2SO3
(3)abd
(4)SO3(g)+H2O(l)===H2SO4(l)
ΔH=-130.3 kJ/mol
(5)①SO2+Br2+2H2O===4H++2Br-+SO
②14.56 2.31 g
13.(8分)(2009·北京理综,28)以黄铁矿为原料生产硫酸的工艺流程图如下:
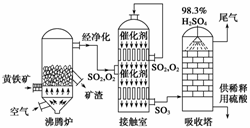
|
4 +11O2= ==2Fe2O3+8SO2
(2)接触室中发生反应的化学方程式是
________________________________________________________________________。
(3)依据工艺流程图判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)每160 g SO3气体与H2O化合放出260.6 kJ的热量,该反应的热化学方程式是
________________________________________________________________________
________________________________________________________________________。
(5)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中 的Br2。SO2吸收Br2的离子方程式是
________________________________________________________________________。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00 mL相同浓度 的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后 用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00 g和20.00 g 时,浓硫酸增加的质量相同;铵盐质量为30.00 g时,浓 硫酸增加的质量为0.68 g;铵盐质量为40.00 g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %; 若铵盐质量为15.00 g,浓硫酸增加的 质量为 。(计算结果保留两位小数)
解析 本题主要考查硫酸工业、热化学方程式的书写、计算等。
(1)根据原子守恒即可判断该物质为FeS2。
 (2)SO2和O2在接触室发生反应生成SO3:2SO2+O2催化剂△ 2SO3。
(2)SO2和O2在接触室发生反应生成SO3:2SO2+O2催化剂△ 2SO3。
(3)选项a,将黄铁矿粉碎增加反应接触面积而加快反应速率;选项b,增加空气(O2) 浓度能提高SO2的转化率;选项c,催化剂对转化率无影响;选项d,矿渣中含有Fe2O3, 可用于冶炼铁。
(4)160 g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6 kJ热量,则1 mol SO3(g)与H2O(l) 反应生成H2SO4(l)放出130.3 kJ热量,则相关热化学方程式为:
SO3(g)+H2O(l)===H2SO4(l);ΔH=-130.3 kJ/mol。
(5)10 g时说明铵盐不足,20 g时说明氢氧化钠不足,由10.00 g和20.00 g 时浓硫酸增加 的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为c mol/L,设10 g中有x mol的(NH4)2SO4和y mol的NH4HSO4,则
132x+115y=10(1)
10 g时说明铵盐不足由N守恒知
n(NH3)=2x+y
20 g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2x mol,2y mol的 NH4HSO4
HSO+OH-===SO+H2O
1 1
2y 2y
NH+OH- === NH3+H2O
1 1
50c×10-3-2y 50c×10-3-2y
由于产生的氨气一样多
n(NH3)=2x+y=50c×10-3-2y(2)
30 g时铵盐过量,则(NH4)2SO4为3x mol,3y mol的NH4HSO4 n(NH3)=0.68/17=0.04 mol
HSO+OH-===SO+H2O
1 1
3y 3y
NH+OH- === NH3+H2O
1 1
50c×10-3-3y 0.04
所以
50c×10-3-3y=0.04(3)
联立(1)(2)(3)解得
x=0.02 mol y=0.064 mol c=4.64 mol/L
氮的质量百分含量=×100%=(0.04+0.064) ×14/10×100%=14.56%
15 g时铵盐已经过量,则(NH4)2SO4为1.5x mol,1.5 y mol的NH4HSO4
HSO+OH-===SO+H2O
1 1
12.(2010·东莞质检)硒(Se)是人体必需的一种微量元素,其单质可用于制光敏电阻、复 印机的硒鼓等等。工业上提取硒的方法之一是用硫酸和硝酸钠处理含硒的工业废料,得 到亚硒酸(H2SeO3)和少量硒酸(H2SeO4),富集后再将它们与盐酸共热,将H2SeO4转化为 H2SeO3,主要反应为2HCl+H2SeO4===H2SeO3+H2O+Cl2↑,然后向溶液中通入SO2 将硒元素还原为单质硒沉淀。据此正确的判断为 ( )
A.H2SeO4的氧化性比Cl2弱
B.SeO2的氧化性比SO2弱
C.H2SeO4的氧化性比H2SeO3强
D.浓H2SeO4的氧化性比HNO3强
解析 根据方程式可知氧化性:H2SeO4>H2SeO3,H2SeO4>Cl2,所以A项错误,C项正 确;SO2可以把H2SeO3还原为Se单质,说明+4价Se的氧化性比SO2强,所以B项错 误;由题意知HNO3能将工业废料中的硒氧化为H2SeO3和少量H2SeO4,所以HNO3的 氧化性比H2SeO4强,D项错误。
答案 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com