
6、(14分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
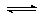 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 molH-O键
c. c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
6 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。(取小数二位,下同)
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K=_______.
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
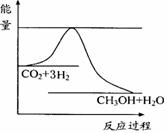 CO2(g)+3H2(g)
CO2(g)+3H2(g)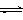 CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
(4)利用甲醇设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,采用铂或碳化钨作为电极催化剂。则通入氧气的电极应为 极(填写“正”或“负”), 放入甲醇的电极上发生的电极反应是
5.(13分)(1)8Al+3Fe3O44Al2O3+9Fe (2分)
(2)①煮沸 (1分)
②负 (1分) 生成白色沉淀 (1分)
Fe-2e-+2OH-===Fe(OH)2 ↓ (2分)
③4Fe(OH)2+O2+2H2O===4Fe(OH)3 (3分)
(3)FeaOb (3分)
[解析](1)R为Fe,Fe在X(O2)中燃烧生成甲(Fe3O4),Fe3O4在高温下与Al发生铝热反应生成Fe和Al2O3:8Al + 3Fe3O44Al2O3+ 9Fe。
(2)①由于Fe(OH)2易被O2氧化,所以配制NaCl、NaOH混合液中需通过加热煮沸的方法除去溶解在溶液中的O2。
②R与电源正极相连,失去电子产生Fe2+,所以石墨应连接电源的负极。Fe失去电子生成的Fe2+与溶液中的OH―反应生成白色的Fe(OH)2沉淀,其电极反应为:Fe-2e-+2OH―===Fe(OH)2↓。
③Fe(OH)2被空气中的O2氧化生成红褐色的Fe(OH)3:4Fe(OH)2+ O2+2H2O===4Fe(OH)3↓。
(3)R的氧化物与Al发生铝热反应后生成的Fe与盐酸反应产生H2(假设为a mol),等量的R的氧化物和Al粉混合物与NaOH溶液反应时,Al与NaOH溶液反应产生H2(假设为b mol)。根据Fe-H2,Al-1.5H2,Al-1.5O,可得R中含有a mol Fe,b mol O,故R的化学式为FeaOb。
5.(13分)M、R都是生活中常见的金属单质,其中R是用量最多的金属。甲、乙是化合物,其中甲是黑色晶体,可由R在X中燃烧得到。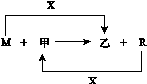
(1)M与甲在高温下反应的化学方程式是
(2)电解法制R低价氢氧化物的装置如图。a是4 mol·L-1NaCl、
1 mol·L-1NaOH的混合溶液。
①配制a时需要除去蒸馏水中溶解的O2,常采用 的方法。
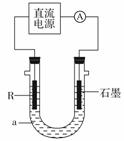 ②石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 。
②石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 。
③停止实验一段时间后,在R极上部有红褐色物质产生,反应的化学方程式是 。
(3)把R的某氧化物粉末与M粉末混合后分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是a∶b,则R的氧化物的化学式是 。
4.(16分):每空2分
(1)226.3kJ
(2)①低于 ②c ③n/3;2.08
(3)①0.00592mol·L-1·s-1
②H2+CO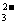 -2e-=
-2e-= CO2+H2O
CO2+H2O
阳极:N2 O4+2HNO3-2e-=2N2O3+2H+
O4+2HNO3-2e-=2N2O3+2H+
4.(16分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol

 N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ/mol
 2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
若有17g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为 。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氧气的
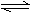 物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 (填字母)。
③在起始体系中加入N2的物质的量为 mol时,反应后氨的百分含量最大。若容器容积为H,n=3mol反应达到平衡时H2的转化率为60%,则此条件下(T2),反应的平衡常数K= 。
(3)N2O3是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O3可发生下列反应:
 2N2O3 4NO2(g)
△H>0下表为反应在T1温度下的部分实验数据
2N2O3 4NO2(g)
△H>0下表为反应在T1温度下的部分实验数据
|
Vs |
0 |
500 |
1000 |
|
c(N2O3)/mol·L-1 |
5.00 |
3.52 |
2.48 |
②现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O3,装置如图所示,其中Y为CO2。
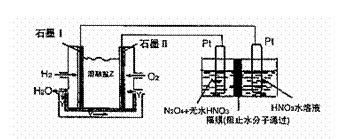
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O3的电极反应式为 。
3.(14分)
 (1)a c ………………………………………………………………2分
(1)a c ………………………………………………………………2分
 (2)2Fe2++H2O2+2H+=2Fe3++2H2O ………………………………3分
(2)2Fe2++H2O2+2H+=2Fe3++2H2O ………………………………3分
 (3)10KOH + 3Cl2 + 2Fe(OH)3
== 2K2FeO4 + 6KCl + 8H2O ………………3分
(3)10KOH + 3Cl2 + 2Fe(OH)3
== 2K2FeO4 + 6KCl + 8H2O ………………3分
(4)Fe(OH)3-3e-+5OH-=FeO42-+4H2O …………………………3分
1 ……………………………………………………………3分
3.(14分)E和M均为生活中常见的金属元素。现有如下反应关系:
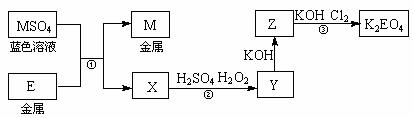
 (1)反应①的反应类型是____________________(填序号)。
(1)反应①的反应类型是____________________(填序号)。
a.氧化还原反应 b.复分解反应 c.置换反应
 (2)Y的溶液可使KSCN溶液显红色。反应②的离子方程式是____________________。
(2)Y的溶液可使KSCN溶液显红色。反应②的离子方程式是____________________。
 (3)K2EO4为高效绿色净水剂,可通过反应③制得。反应③的化学方程式是
(3)K2EO4为高效绿色净水剂,可通过反应③制得。反应③的化学方程式是
____________________。
(4)用K2EO4和Zn作原料的电池是一种新型可充电电池,该电池长时间保持稳定的放电电压。其总反应可写成:3Zn+2K2EO4+8H2O 3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5 g Zn时转移 mol电子。
3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5 g Zn时转移 mol电子。
2.(每空2分,共12分)
(1)NO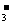 +Al+H2O→Al(OH)3+N2+OH- 5:3
+Al+H2O→Al(OH)3+N2+OH- 5:3
(2)2H2O+O2+4e-=4OH-
铂性质稳定不与氧气反应,网状结构可以增大与氧气的接触面积。
(3)2Al(s)+Fe2O3(s)=2Fe(s)=2Fe(s)+Al2O3(s) △H=-593.1kJ/mol
(4)2.016
2.(12分)(1)环境专家认为可以用金属铝将水体中的NO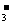 转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH
转化为N2,从而清除污染。该反应中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO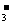 、N2,请将各粒子分别填入以下空格内(不用配平)。
、N2,请将各粒子分别填入以下空格内(不用配平)。
+ + + +
该反应过程中,被氧化与被还原的元素的物质的量之比为 。
(2)我国首创的海洋电池以海水为电解质溶液,电池总反应为:4Al+3O2+6H2O=
4Al(OH)3。电池正极的电极反应式为 ;正极材料采用了铂网,利用铂网为正极的优点是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s)
△H=234.1kJ/mol
CO2(g)+2Fe(s)
△H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
写出铝与氧化铁发生铝热反应的热化学方程式 。
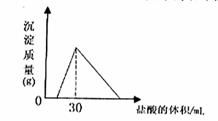 (4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
(4)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L盐酸滴定,可得沉淀质量与消耗的盐酸体积关系如下图:
1.(每空2分,共12分)
(1)2周期VA族
(2)3Cu+8H++2NO-3=3Cu2++2NO↑+4H2O;NaNO2
(3)-173.4kJ·mol-1;ab
(4)1:3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com