
相信学生,就是相信在他们身上蕴藏着巨大的创造潜力。相信每一个学生都有创造能力,老师就要像地质勘探队员一样,细心勘探,发现深处的宝藏,把它们开发、挖掘出来。
有了相信学生的思想,就会真正尊重学生的学习主体地位,保证学生有充分的自学的时间,思考的时间,合作学习的时间,交流讨论的时间,动手操作的时间。
21.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是 有机合成工业的一种原料。工业上曾用
有机合成工业的一种原料。工业上曾用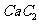 与水反应生成乙炔。
与水反应生成乙炔。
(1) 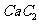 中
中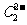 与
与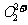 互为等电子体,
互为等电子体,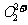 的电子式可表示为 ▲ ;1mol
的电子式可表示为 ▲ ;1mol 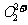 中含有的
中含有的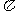 键数目为 ▲ 。
键数目为 ▲ 。
(2)将乙炔通入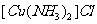 溶液生成
溶液生成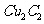 ,红棕色沉淀。
,红棕色沉淀。 基态核外电子排布式为 ▲ 。
基态核外电子排布式为 ▲ 。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈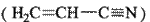 。丙烯腈分子中碳原子轨道杂化类型是 ▲ ;分子中处于同一直线上的原子数目最多为 ▲ 。
。丙烯腈分子中碳原子轨道杂化类型是 ▲ ;分子中处于同一直线上的原子数目最多为 ▲ 。
(4) 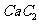 晶体的晶胞结构与
晶体的晶胞结构与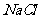 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但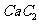 晶体中含有的中哑铃形
晶体中含有的中哑铃形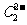 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。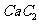 晶
晶 体中1个
体中1个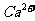 周围距离最近的
周围距离最近的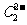 数目为 ▲ 。
数目为 ▲ 。
B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
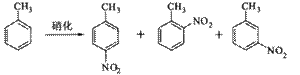
一种新的制备对硝基 甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在溶剂中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在溶剂中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是▲ 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于▲ 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有▲ 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
|
催化剂 |
n(催化剂) |
硝化产物中各种异构体质量分数(%) |
总产率(%) |
||
|
n(甲苯) |
对硝基甲苯 |
邻硝基甲苯 |
间硝基甲苯 |
||
|
浓H2SO4 |
1.0 |
35.6 |
60.2 |
4.2 |
98.0 |
|
1.2 |
36.5 |
59.5 |
4.0 |
99.8 |
|
|
NaHSO4 |
0.15 |
44.6 |
55.1 |
0.3 |
98.9 |
|
0.25 |
46.3 |
52.8 |
0.9 |
99.9 |
|
|
0.32 |
47.9 |
51.8 |
0.3 |
99.9 |
|
|
0.36 |
45.2 |
54.2 |
0.6 |
99.9 |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 ▲
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 ▲ 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ ▲ 、 ▲ 。


19. (14分)阿立哌唑(A)是一种新的抗精神分裂症药物,可由化合物B、C、D在有机溶剂中通过以下两条路线合成得到。
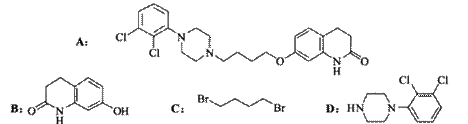
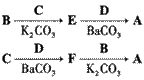
线路一:
线路二:
(1)E的结构简式为 ▲ 。
(2)由C、D生成化合物F的反应类型是 ▲ 。
(3)合成F时还可能生成一种相对分子质量为285的副产物G,G的结构简式为 ▲ 。
(4)H属于 氨基酸,与B的水解产物互为同分异构体。H能与
氨基酸,与B的水解产物互为同分异构体。H能与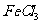 溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式: ▲ 。
溶液发生显色反应,且苯环上的一氯代物只有2种。写出两种满足上述条件的H的结构简式: ▲ 。
(5)已知: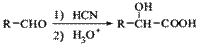 ,写出由C制备化合物
,写出由C制备化合物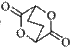 的合成路
的合成路
线流程图(无机试剂任选)。合成路线流程图示例如下:
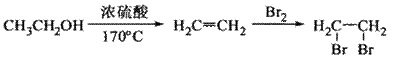
 20(10分)以水氯镁石(主要成分为
20(10分)以水氯镁石(主要成分为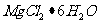 )为原料生产碱式碳酸镁的主要流程如下:
)为原料生产碱式碳酸镁的主要流程如下:
(l)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Mg(OH)2的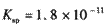 ,若溶液中
,若溶液中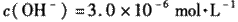 ,则溶液中 ▲ 。
,则溶液中 ▲ 。
(2)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为 ▲ 。
(3)高温煅烧碱式碳酸镁得到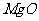 。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下
。取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g和标准状况下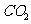 0.896L,通过计算确定碱式碳酸镁的化学式。
0.896L,通过计算确定碱式碳酸镁的化学式。
(4)若热水解不完全,所得碱式碳酸镁中将混有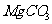 ,则产品中镁的质量分数 ▲ (填
“升高”、“降低”或“不变”)。
,则产品中镁的质量分数 ▲ (填
“升高”、“降低”或“不变”)。
18.(12分)正极材料为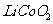 的锂离子电池被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
的锂离子电池被广泛用作便携式电源。但钴的资源匮乏限制了其进一步发展。
(1)橄榄石型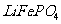 是一种潜在的锂离子电池正极材料,它可以通过
是一种潜在的锂离子电池正极材料,它可以通过 、
、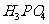 与
与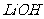 溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。
溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。
①共沉淀反应投料时,不将 和
和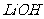 溶液直接混合的原因是▲ 。
溶液直接混合的原因是▲ 。
②共沉淀反应的化学方程式为▲ 。
③高温成型前,常向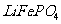 中加入少量活性炭黑,其作用除了可以改善成型后的
中加入少量活性炭黑,其作用除了可以改善成型后的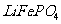 的导电性能外,还能▲ 。
的导电性能外,还能▲ 。
(2)废旧锂离子电池的之极材料试样(主要含有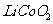 及少量AI、Fe等)可通过下列实验方法回收钴、锂。
及少量AI、Fe等)可通过下列实验方法回收钴、锂。
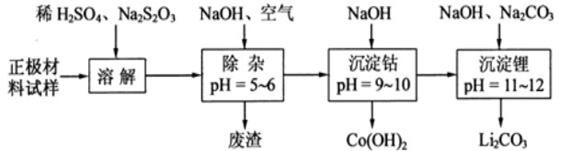
①
 在上述溶解过程中,
在上述溶解过程中,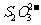 ,
,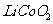 在溶解过程中反应的化学方程式为▲ 。
在溶解过程中反应的化学方程式为▲ 。
②
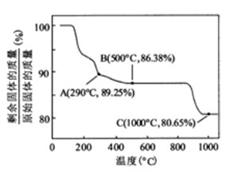
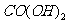 在空气中加热时,固体残留率随温度的变化
在空气中加热时,固体残留率随温度的变化
如右图所示。已知钴的氢氧化物加热至290℃时已完全
脱水,则1000℃时,剩余故土成分为▲ 。(填化学式);
在350~400℃范围内,剩余故土成分为▲ 。(填化学式)。
17.(8分)下表列出了3种燃煤烟气脱硫方法的原理。
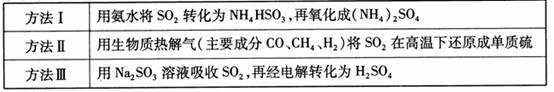
(1) 方法Ⅰ中氨水吸收燃煤烟气中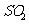 的化学反应为
的化学反应为
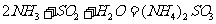
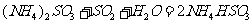
能提高燃煤烟气中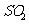 去除率的措施有 ▲
(填字母)。
去除率的措施有 ▲
(填字母)。
A.增大氨水浓度 B.升高反应温度
C.使燃煤烟气与氨水充分接触 D. 通入空气使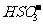 转化为
转化为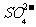
采用方法Ⅰ脱硫,并不需要先出去燃煤烟气中大量的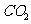 ,原因是▲(用离子方程式表示)。
,原因是▲(用离子方程式表示)。
(2) 方法Ⅱ重要发生了下列反应:
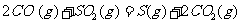
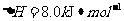
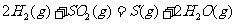
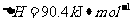
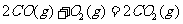
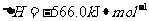
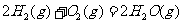
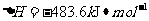
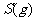 与
与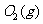 反应生成
反应生成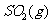 的热化学方程式为▲ 。
的热化学方程式为▲ 。
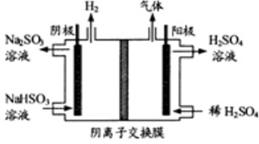
(3) 方法Ⅲ中用惰性电极电解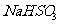 溶液的装置
溶液的装置
如右图所示。阳极区放出的气体的成分为▲ 。
(填化学式)
16.(10分)钡盐行业生产中 排出大量的钡泥[主要含
排出大量的钡泥[主要含 有
有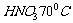
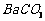 、
、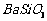 、
、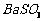 、
、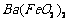 等]。某主要生产
等]。某主要生产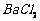 、
、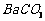 、
、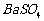 的化工厂利用钡泥制取
的化工厂利用钡泥制取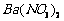 ,其部分工艺流程如下:
,其部分工艺流程如下:
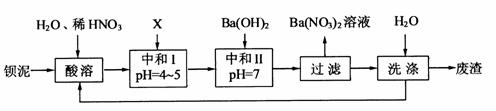
(1)酸溶后溶液中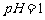 ,
,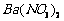 与
与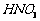 的反应化学方程式为
。
的反应化学方程式为
。
(2)酸溶时通常控制反应温度不超过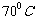 ,且不使用浓硝酸,
,且不使用浓硝酸,
原因是 、 。
(3)该厂结合本厂实际,选用的X为 (填化学式);中和Ⅰ使溶液中 (填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略)。
(4)上述流程中洗涤的目的是 。
15. (12分)高纯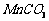 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以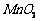 为原料制备少量高纯
为原料制备少量高纯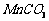 的操作步骤如下:
的操作步骤如下:
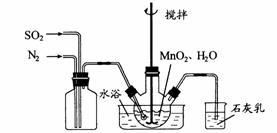 (1)制备
(1)制备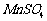 溶液:
溶液:
在烧瓶中(装置见右图)加入一定量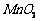 和水,搅拌,
和水,搅拌,
通入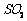 和
和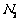 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入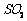 ,
,
继续反应片刻,过滤(已知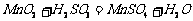 )
)
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使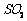 尽可能转化完全,在通入
尽可能转化完全,在通入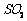 和
和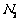 比例一定、不改变固液投料的条件下,可采取的合理措施有
、
。
比例一定、不改变固液投料的条件下,可采取的合理措施有
、
。
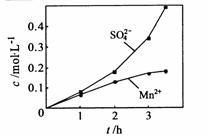 ③若实验中将
③若实验中将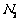 换成空气,测得反应液中
换成空气,测得反应液中
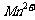 、
、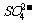 的浓度随反应时间t的浓度变化如右图。
的浓度随反应时间t的浓度变化如右图。
导致溶液中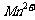 、
、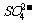 浓度变化产生明显差异的
浓度变化产生明显差异的
原因是 。
(2)制备高纯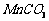 固体:已知
固体:已知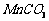 难溶于水、乙醇,潮湿时易被空
难溶于水、乙醇,潮湿时易被空 气氧化,
气氧化,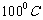 开始分解;
开始分解;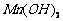 开始沉淀时
开始沉淀时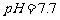 。请补充由(1)时制得的
。请补充由(1)时制得的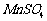 制备高纯
制备高纯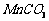 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂:  、
、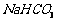 、
、 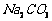 、
、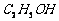 ]。
]。
① ;② ;③ ;④ ;⑤低于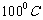 。
。
14.在温度、容积相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知
投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知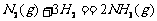 ⊿H=-92.4kJ·mol-1)
⊿H=-92.4kJ·mol-1)
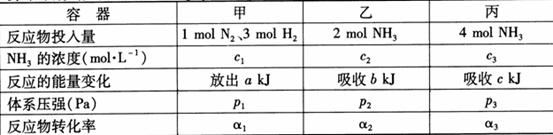
下列说法正确的是
A. 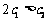 B.
B.  C.
C. 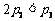 D.
D. 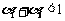
非选择题
13. 已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金 是日常生活中常用的金属材料。下列说法正确的是
是日常生活中常用的金属材料。下列说法正确的是
A. 元素A、B组成的化合物常温下一定呈气态
B. 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C. 工业上常用电解法制备元素C、D、E的单质
D. 化台物AE与CE古有相同类型的化学键
12.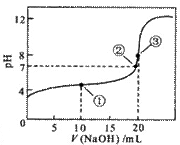 常温下,用 0.1000
常温下,用 0.1000 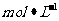 NaOH溶液滴定 20.00
NaOH溶液滴定 20.00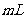 0.10000
0.10000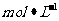
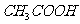 溶液滴定曲线如右图。下列说法正确的是
溶液滴定曲线如右图。下列说法正确的是
A. 点①所示溶液中:
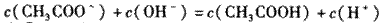
B. 点②所示溶液中:
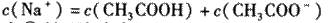
C. 点③所示溶液中:
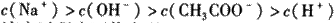
D. 滴定过程中可能出现:
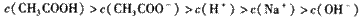
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com