
5.(2009·四川理综,11)向m g镁和加NaOH溶液的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是 ( )
A.c= B.p=m+
C.n=m+17Vc D.m<p<m
解析 向m g Mg、Al的混合物中加入适量的稀H2SO4,恰好完全反应,溶液中只有MgSO4、Al2(SO4)3两种物质,且Mg2+与Al3+的质量和为m g;向反应后的溶液中加入c mol/L KOH溶液V mL,使金属离子恰好完全沉淀,发生的反应是:Mg2++2OH-===Mg(OH)2↓,Al3++3OH-===Al(OH)3↓,则得到沉淀的质量是Mg2+、Al3+的质量与NaOH溶液中OH-质量的质量和,所以n=m+V×10-3×c×17=m+1.7×10-2 Vc,C项错误。
答案 C
4.(2009·江苏,3) 下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 ( )
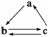
|
物质选项 |
a |
b |
c |
|
A |
Al |
AlCl3 |
Al(OH)3 |
|
B |
HNO3 |
NO |
NO2 |
|
C |
Si |
SiO2 |
H2SiO3 |
|
D |
CH2===CH2 |
CH3CH2OH |
CH3CHO |
 解析 A中的Al(OH)3无法通过一步反应制得Al,A错误;HNO3(稀)NO,NOO2H2O NO2,NO2HNO3,B正确;SiO2不溶于水,无法通过一步反应制得H2SiO3,C错误;CH3CHO无法通过一步反应制得乙烯,D错误。
解析 A中的Al(OH)3无法通过一步反应制得Al,A错误;HNO3(稀)NO,NOO2H2O NO2,NO2HNO3,B正确;SiO2不溶于水,无法通过一步反应制得H2SiO3,C错误;CH3CHO无法通过一步反应制得乙烯,D错误。
答案 B
3.(2009·上海,22改编)实验室将9 g加NaOH溶液粉跟一定量的金属氧化物粉末混合形成加NaOH溶液热剂。发生加NaOH溶液热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是( )
①Fe2O3和MnO2 ②MnO2和V2O5
③Cr2O3和V2O5 ④Fe3O4和FeO
A.①④ B.②③ C.①③ D.②④
解析 n(Al)==mol,Al完全反应时转移电子的物质的量为mol×3=1 mol,则生成金属的摩尔电子质量(转移1 mol e-生成金属的质量)为18 g/mol。
①项生成Fe的摩尔电子质量为=18.67 g/mol,生成Mn的摩尔电子质量为=13.75 g/mol,根据平均值规律,①项正确;②项生成Mn的摩尔电子质量为13.75 g/mol,生成V的摩尔电子质量为=10.2 g/mol,根据平均值规律,②项不可能生成单质18 g;同理,③项也不可能生成单质18 g;④项Al完成反应时生成Fe的质量大于18 g,当氧化物粉末不足量时,生成的金属可能为18 g,④项正确。
答案 A
2.(2009·上海,15)镁和加NaOH溶液分别
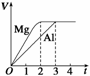
与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图。反应中镁和加NaOH溶液的( )
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
解析 镁与稀硫酸反应:Mg+H2SO4===MgSO4+H2↑,加NaOH溶液与稀硫酸反应:2Al+3H2SO4===Al2(SO4)3+3H2↑,由图象知,产生的H2的量相同,各产生1 mol H2时,需Mg 1 mol,质量为24 g;需Almol,质量为18 g。故A正确,B、C错误。Mg的反应速率大于Al的,D错误。
答案 A
1.(2009·江苏,5)化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
解析 电解饱和MgCl2溶液发生的反应为:MgCl2+2H2OMg(OH)2↓+H2↑+Cl2↑,无法制得金属镁。
答案 D
52.(10分)
老鼠皮毛的颜色黄色对非黄色为显性(用A、a表示),正常耳朵对卷耳为显性(用T、t表示),控制该两对性状的基因分别位于两对同源染色体上。且毛色中的显性纯合在出生前全部死亡。请回答:
(1)请设计一个实验来判断表现型为正常耳朵的小鼠的基因型 。
(2)若只考虑皮毛的颜色这一对相对性状:
①将黄色鼠和非黄色鼠杂交,后代的表现型及比例为 。
②黄毛鼠种内杂交,后代表现型比为2:1,则双亲的基因型分别是 。
(3)基因型为AaTT和AaTt雌雄老鼠杂交,F1中的基因型及比例为 。
51.(10分)
下列是科学家艾弗里及其同事利用肺炎双球菌来探究什么是遗传物质的部分过程。
实验材料、用具:S型细菌、R型细菌、DNA酶、培养基、培养皿等。
艾弗里等人先做了以下三组实验:
①S型细菌的蛋白质+R型活细菌→R型菌落;
②S型细菌的荚膜多糖+R型活细菌→R型菌落;
③S型细菌的DNA+R型活细菌→S型菌落。
(1)肺炎双球菌属于 (原核/真核)生物。
(2)艾弗里等人后来发现上述实验过程并不严密,于是又做了第四组实验。请参考实验材料并按照①②③中表达式写出第四组实验方法和结果:
④ 。
(3)从上述实验可以得出的结论是___ _。
(4)艾弗里等人北实验的设计思路是___ _。
50.(10分)
鸟类的性别决定是ZW型,雌性为异型性染色体(ZW),雄性为同型性染色体 (ZZ)。家鸡羽毛芦花(B)对非芦花(b)为显性且基因位于Z染色体上。现有一只芦花公鸡与一只非芦花母鸡交配,产生的后代中芦花和非芦花性状雌雄各占一半。试分析:
(1)上述实例中,作为亲本的两只鸡的基因型分别为:雄__ 、雌 。
(2)请你设计一个杂交方案,以便能在早期判别雏鸡的性别(用遗传图解表示杂交方案)。
(3)若此方案可行,辨别雌雄的依据是 。
49.已知绵羊角的表现型与墓因型的关系如下表,下列判断正确的是 ( )
|
基因型 |
HH |
Hh |
hh |
|
公羊的表现型 |
有角 |
有角 |
无角 |
|
母羊的表现型 |
有角 |
无角 |
无角 |
A.若双亲无角,则子代全部无角
B.若双亲有角,则子代全部有角
C.若双亲基因型为Hh,则子代性状分离比为1:1
D.绵羊角的性状遗传不遵循基因的分离定律
48.孟德尔遗传规律并不适合于肺炎双球菌,是因为肺炎双球菌 ( )
A.没有遗传物质 B.没有核物质
C.没有完善的细胞器 D.不能进行有性生殖
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com