
14.(9分)(2008·重庆理综,27)某学习小组用如图所示装置测定加NaOH溶液镁合金中加NaOH溶液的质量分数和加NaOH溶液的相对原子质量。

(1)A中试剂为________________。
(2)实验前,先将加NaOH溶液镁合金在稀酸中浸泡片刻,其目的是
________________________________________________________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性。上述操作的顺序是__________(填序号);记录C的液面位置时,除视线平视外,还应________________________________________________________________________。
(4)B中发生反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(5)若实验用加NaOH溶液镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则加NaOH溶液的相对原子质量为____________________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得加NaOH溶液的质量分数将__________(填“偏大”、“偏小”或“不受影响”)。
解析 (1)观察实验装置图可知是用量气法完成实验目的,故A中应盛NaOH溶液,在B中发生2Al+2NaOH+2H2O===2NaAlO2+3H2↑的反应。
(2)目的是除去加NaOH溶液镁合金表面的氧化膜。
(3)正确顺序应为⑤①④③②;为使C中气体的压强与外界大气压相等,还应使D与C的液面相平。
(5)据2Al - 3H2
2 3
得M(Al)=
(6)据w(Al)=×100%的计算公式可知未洗涤不溶物会造成加NaOH溶液的质量分数偏小。
答案 (1)NaOH溶液 (2)除去加NaOH溶液镁合金表面的氧化膜
(3)⑤①④③② 使D和C的液面相平
(4)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
(5) (6)偏小
13.(10分)(2009·广东,24)超细氧化加NaOH溶液是一种重要的功能陶瓷原料。
(1)实验室常以NH4Al(SO4)2和NH4HCO3为原料,在一定条件下先反应生成沉淀NH4AlO(OH)HCO3,该沉淀高温分解即得超细Al2O3。NH4AlO(OH)HCO3热分解的化学反应方程式为
________________________________________________________________________
________________________________________________________________________。
(2)NH4Al(SO4)2·12H2O的相对分子质量为453。欲配制100 mL pH为2、浓度约为0.1 mol/L的NH4Al(SO4)2溶液,配制过程为:
①用托盘天平称量NH4Al(SO4)2·12H2O固体
________________________________________________________________________g;
②将上述固体置于烧杯中,
________________________________________________________________________。
(3)在0.1 mol/L NH4Al(SO4)2溶液中,加NaOH溶液各形态的浓度(以Al3+计)的对数(lgc)随溶液pH变化的关系见下图:
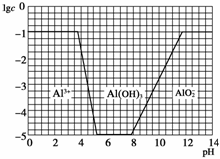
①用NaOH溶液调节(2)中溶液pH至7,该过程中发生反应的离子方程式有________________________________________________________________________
________________________________________________________________________。
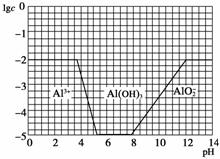
②请画出0.01 mol/L NH4Al(SO4)2溶液中加NaOH溶液各形态的浓度的对数lgc随溶液pH变化的关系图,并进行必要的标注。
解析 (1)根据题中信息及元素守恒NH4AlO(OH)HCO3热分解的产物除Al2O3外还应有NH3、H2O和CO2:2NH4AlO(OH)HCO3Al2O3+2NH3↑+3H2O+2CO2↑。
(2)①n[NH4Al(SO4)2]=0.1 L×0.1 mol/L=0.01 mol
m[NH4Al(SO4)2·12H2O]=0.01 mol×453 g/mol=4.53 g≈4.5 g
称量→称量→溶解→移液→洗涤→定容。
(3)①从图中可看出pH=7时,Al元素全部以Al(OH)3形式存在。
②依据题中给出的0.1 mol/L NH4Al(SO4)2的图象,可画出0.01 mol/L的图象,同时标明加NaOH溶液元素的存在形态Al3+、Al(OH)3、AlO即可。
答案 (1)2NH4AlO(OH)HCO3Al2O3+2NH3↑+3H2O+2CO2↑
移液→移液→洗涤→定容
(3)①Al3++3OH-===Al(OH)3↓,
H++OH-===H2O,
NH+OH-===NH3·H2O
②
12.(2009·盐城调研)将一定质量的Mg和Al混合物

投入500 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。则下列说法正确的是 ( )
A.Mg和Al的总质量为8 g
B.硫酸的物质的量浓度为5 mol/L
C.生成的H2在标准状况下的体积为11.2 L
D.NaOH溶液的物质的量浓度为5 mol/L
解析 由图可知,固体中含有0.15 mol的Mg和0.2 mol的Al,所以总质量为9 g;与硫酸反应生成的氢气的体积应为(0.15 mol+0.3 mol)×22.4 L/mol=10.08 L;在加入240 mL NaOH溶液时,Al(OH)3恰好全部转化为NaAlO2,所以氢氧化钠溶液的浓度为=5 mol/L。
答案 D
0.05 mol/L 0.20 mol/L
根据溶液中的电荷守恒
3c(Al3+)+c(K+)=2c(SO)
c(K+)=2×0.20 mol/L-3×0.05 mol/L=0.25 mol/L。
答案 B
11.(2010·娄底联考)硫酸加NaOH溶液、硫酸钾、明矾三种物质组成的混合物中,当SO的浓度为0.20 mol/L时,加入等体积的0.20 mol/L的KOH溶液(混合溶液体积变化忽略不计),使生成的白色沉淀恰好溶解,那么反应后溶液中K+的浓度为 ( )
A.0.20 mol/L B.0.25 mol/L
C.0.225 mol/L D.0.45 mol/L
解析 Al3+ + 4OH-===AlO+2H2O
1 4
10.(2009·平顶山模拟)下列操作所得物质为纯净物的是 ( )
A.将一块带有氧化膜的加NaOH溶液片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体
B.向NaAlO2溶液中加入过量的AlCl3溶液,将所得沉淀过滤洗涤,加热灼烧去掉水分,可得纯净的Al(OH)3固体
C.把加NaOH溶液块与适量的稀盐酸完全反应,将所得溶液蒸干,可得AlCl3固体
D.把AlCl3溶液与足量氨水反应,将沉淀过滤、洗涤、灼烧去掉水分可得Al2O3固体
答案 D
9.(2010·扬州模拟)若在加入加NaOH溶液粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是 ( )
A.NH NO CO Na+
B.Na+ Ba2+ Mg2+ HCO
C.NO Ca2+ K+ Cl-
D.NO K+ AlO H+
答案 C
8.(2010·海口调研)下列有关金属加NaOH溶液及其化合物的叙述正确的是 ( )
A.加NaOH溶液在常温下不能与氧气反应
B.加NaOH溶液不能与氯气反应
C.加NaOH溶液既能溶于酸,又能溶于碱
D.氧化加NaOH溶液只能与酸反应,不能与碱反应
解析 加NaOH溶液在常温下可和O2反应,A错;加NaOH溶液能与氯气反应,B错;氧化加NaOH溶液是两性氧化物,既能与酸反应又能与碱反应,D错。
答案 C
7.(2010·潍坊模拟)下列各反应的离子方程式中,错误的是( )
A.硫酸加NaOH溶液溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH
B.铁片放入过量的稀硝酸中:3Fe+8H++2NO===3Fe2++2NO2↑+4H2O
C.将加NaOH溶液片放入过量NaOH溶液中:2Al+2OH-+2H2O===2AlO+3H2↑
D.偏加NaOH溶液酸钠与过量盐酸反应:AlO+4H+===Al3++2H2O
答案 B
6.(2008·广东,6)相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是 ( )
A.Al B.Al(OH)3
C.AlCl3 D.Al2O3
解析 根据化学反应物质的量关系:A:1 mol Al-1 mol NaOH,B:1 mol Al(OH)3-1 mol NaOH,C:1 mol AlCl3-4 mol NaOH,D:1 mol Al2O3-2 mol NaOH。若消耗4 mol NaOH,需要m(Al)=4 mol×27 g/mol=108 g,需要m[Al(OH)3]=78 g/mol×4 mol=312 g,需要m(AlCl3)=1 mol×133.5 g/mol=133.5 g,需要m(Al2O3)=2 mol×102 g/mol=204 g。由以上判断可知,相同质量时Al消耗NaOH最多。
答案 A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com