
10.下列叙述正确的是 ( )
①7Li+中含有的中子数与电子数之比为2:1
②在C2H6分子中极性共价键与非极性共价键数之比为3:1
③常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1
④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2:1
 A.①② B.②③ C.①③ D.③④
A.①② B.②③ C.①③ D.③④
7.下列物质不是按化合物、单质、混合物顺序排列的是 ( )
A.纯碱、液氯、医用酒精 B.生石灰、白磷、水玻璃
C.干冰、铁、纯净的盐酸 D.三溴苯酚、氮气、明矾
|
 A.氯化铵与氢氧化钠两种溶液混合加热:NH4++OH-
NH3↑+H2O
A.氯化铵与氢氧化钠两种溶液混合加热:NH4++OH-
NH3↑+H2O
B.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu Fe2++Cu2+
C.氢氧化钠溶液中通入少量二氧化硫气体:SO2+OH- HSO3-
D.氯化铝溶液中加入过量氨水:Al3++3NH3·H2O Al(OH)3↓+3NH4+
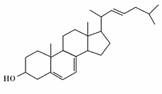 9.麦角醇(ergosterol)在紫外光照射下可转化为抗软骨病的维生素D2,麦角醇的结构如右图所示,则下列关于该化合物的说法正确的是( )
9.麦角醇(ergosterol)在紫外光照射下可转化为抗软骨病的维生素D2,麦角醇的结构如右图所示,则下列关于该化合物的说法正确的是( )
A.属于芳香族化合物
B.在一定条件下可发生酯化、加成、取代和氧化等反应
C.1H核磁共振谱证明分子中核磁共振谱有十个峰
D.不能使Br2/CCl4溶液褪色
6.以下有关教材中实验的叙述正确的是 ( )
A.通过加热和加入酶都可以降低过氧化氢分解所需要的活化能,从而加快过氧化氢的分解速率
B.“低温诱导植物染色体数目的变化”的实验的基本步骤是:培养不定根→低温诱导→卡洛氏液固定→解离→漂洗→染色→制片→观察
C.将两个胚芽鞘放在某一小块琼脂块上12小时,发现琼脂块中的生长素浓度接近胚芽鞘中的生长素浓度,则换成四个胚芽鞘放在同样大小的琼脂块上,处理同样的时间,其中的生长素浓度将抑制茎的生长
D.“探究培养液中酵母菌种群数量变化”实验计数时,如果在一个小方格边线上有9个酵母菌,则计数时,只需要记为9/2,即4.5个
5.以下的各种数据按照从大到小排列正确的是 ( )
A.某动物体内:氨基酸种类数>蛋白质种类数>核酸的种类数>染色体数
B.呼吸作用中消耗同样多的葡萄糖产生的二氧化碳:人≥酵母菌>蛔虫
C.AA××Aa的连续多代自交后代基因型频率:AA>Aa>aa
D.各种生态系统中各部分的质量:生产者>初级消费者>分解者
4.以下关于物种的说法正确的是 ( )
A.每一物种往往都由多个具有生殖隔离的种群构成
B.我们认为某现存物种和它的祖先是两个物种,其依据是它们的基因库具有较大的差别
C.所谓“共同进化”就是指不同物种之间在相互影响中不断进化和发展
D.真核生物中动物比植物在进化史上后出现的原因是动物必须依赖植物光合作用产生的氧气才能生活
3.已知体内某一大分子物质的分子式是C3032H4816OXN780S8Fe8,由此作出下列结论正确的是( )
A.该物质最可能最蛋白质,组成这个蛋白质分子的氨基酸的最大数目是779个或(X-2)个
B.如果该物质是蛋白质的话,且X≥800,则编码形成该蛋白质的核酸的分子量可以用下列式子计算而来:780×3×核苷酸的平均分子量
C.以上物质含有Fe元素可以说明,无机盐对于维持细胞和生物体的生命活动有重要作用
D.将以上分子置于没有水分的环境下,其空间结构可能发生改变,并可能不再表现特定生理活性
2.对人体的卵巢和皮肤生发层细胞的染色体进行计数,其中不能在两处均看到的数据是 ( )
A.23 B.46 C.69 D.92
1.通过一定方法将细胞质内的各种结构分开后进行元素分析,以下各项中,磷元素含量最低的是 ( )
A.线粒体 B.核糖体 C.中心体 D.内质网
16.(11分)(探究创新题)某混合金属粉末,除Mg外还含有Al、Zn中的一种或两种,含量都在10%以上。某研究小组设计实验探究该混合金属粉末中加NaOH溶液、锌元素的存在。
所用试剂:样品、pH试纸、稀H2SO4、NaOH溶液、稀NH3·H2O
该小组探究过程如下:
●查阅资料:
 ①镁、加NaOH溶液、锌都是白色金属;
①镁、加NaOH溶液、锌都是白色金属;
②锌(Zn)可以与NaOH溶液反应生成H2;
③Zn(OH)2为白色固体,难溶于水,可溶于强碱及NH3·H2O;
④Zn2+易形成络合物[Zn(NH3)4]2+,该络合物遇强酸分解生成Zn2+、NH。
●提出假设:
(1)假设1:该混合金属粉末中除镁外还含有__________;
(2)假设2:该混合金属粉末中除镁外还含有__________;
(3)假设3:该混合金属粉末中除镁外还含有加NaOH溶液、锌。
●实验探究:
基于假设3,甲同学设计了如图1所示的实验方案,乙同学设计了如图2所示的实验方 案:
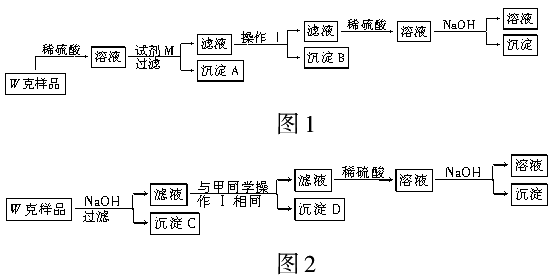

(1)试剂M是__________。
(2)写出操作Ⅰ的过程:
________________________________________________________________________
________________________________________________________________________。
(3)丙同学认为乙同学的方案比甲同学的好,理由是
________________________________________________________________________
________________________________________________________________________。
(4)丁同学研究了甲、乙两同学的方案后,用最简便的方法测定了W g样品中金属镁(Mg)的质量分数,他的方法是
________________________________________________________________________。
答案 提出假设:(1)加NaOH溶液(或Al)
(2)锌(或Zn)(以上两空可颠倒)
实验探究:(1)NaOH溶液
(2)在滤液中加入稀硫酸,直至生成的沉淀刚好溶解,再加入足量的稀氨水
(3)步骤简单,节约试剂
(4)将沉淀C小心洗涤,干燥后称量、计算即可
15.(10分)(2010·滨州质检)实验室可用加NaOH溶液屑、氨水、氢氧化钠溶液、稀硫酸 等来制备氢氧化加NaOH溶液,某同学设计了三种实验方案,
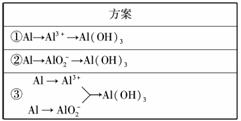

(1)用方案①制备Al(OH)3时使用的药品最好是加NaOH溶液屑、稀硫酸和氨水,不用 氢 氧化钠代替氨水的原因是
________________________________________________________________________
________________________________________________________________________;
写出该方案中有关的离子方程式
________________________________________________________________________。
(2)用方案②来制备Al(OH)3时,必须注意__________的用量,以防止生成的Al(OH)3溶解。
(3)三种方案中,你认为最好的是__________(填序号),原因是
________________________________________________________________________
________________________________________________________________________。
解析 分析本题应从Al(OH)3的两性着手,过量的强酸、强碱均能降低Al(OH)3的产率,而Al3+与AlO反应制取氢氧化加NaOH溶液,则不存在该问题,故③方案最好。
答案 (1)若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量
2Al+6H+===2Al3++3H2↑,
Al3++3NH3·H2O===Al(OH)3↓+3NH
(2)稀硫酸 (3)③ 药品用量减少,操作最为简单
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com