
5.00g C2H8N2完全燃烧可放出212.5kJ热量。下列叙述正确的是 ( )
A.燃烧不一定有氧气参加,也不一定是放热反应
B.火箭点火后,喷出的红色火焰是金属的焰色反应产生的
C.火箭燃料燃烧主要是将化学能转变为热能和光能,可能对环境产生污染
D.偏二甲肼燃烧的热化学方程式是:C2H8N2(g)+2N2O4(g)=2N2(g)+2CO2(g)+4H2O(g);△H=-2550kJ/mol
3.北京时间9月25日21时10分04秒,我国航天事业又迎来一个历史性时刻,我国自行
研制的神舟七号载人飞船在酒泉卫星发射中心发射升空,于28日下午回到美丽的地球。“神
舟”七号汇集了大量最新科技,发射火箭的常规推进剂为四氧化氮和偏二甲肼(C2H8N2),
2.下列变化过程中所发生的反应一定属于氧化还原反应且放热反应的是( )
A.皂化反应 B.铝热反应
C.中和反应 D.可逆反应
1.化学反应中通常伴随着能量变化,下列说法中错误的是 ( )
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
2.吸热反应和放热反应的判断方法
⑴根据反应类型判断:通常情况下燃烧反应、中和反应、金属和酸反应制氢气的反应为放热反应;电解质的电离、盐类水解、大多数的分解反应等为吸热反应。若正反应为吸热反应,则逆反应为放热反应。
⑵根据实验现象判断:使反应体系温度升高的反应,为放热反应。反之为吸热反应。
如:钠与水反应的现象:钠“熔”成一个小球,可以说明这一反应为放热反应;Fe粉与硫的混合物稍微受热后反应继续剧烈进行,且保持红热状态,说明这一反应为放热反应。
在燃烧很旺的炉火中加入煤,炉火马上“暗”下来,说明CO2与C反应为吸热反 应;Ba(OH)2与NH4Cl反应,烧杯与玻璃片粘在一起,说明该反应为吸热反应。
应;Ba(OH)2与NH4Cl反应,烧杯与玻璃片粘在一起,说明该反应为吸热反应。
⑶由物质的聚集状态判断:同种物质的聚集状态不同,其本身具有的能量也不相同。一般情况下:气态物质所具有的能量大于液态,液态具有的能量大于固态;物质处与稳定状态的能量小于不稳定状态的能量。如:硫蒸气在氧气中完全燃烧放出的能量大于固态硫完全燃烧放出的能量。石墨比金刚石稳定,所以由石墨转化为金刚石的反应为吸热反应。
⑷由盖斯定律判断 :
:
如一个反应可分步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同,通 过化学反应的能量变化值来进行计算,若ΔH
> 0,则反应为吸热反应,反之则为放热反应。
过化学反应的能量变化值来进行计算,若ΔH
> 0,则反应为吸热反应,反之则为放热反应。
⑸用仪器来测量:量热计
例4、(2009·上海) 19.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(
19.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(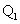 、
、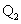 均为正值):
均为正值):

 有关上述反应的叙述正确的是 ( )
有关上述反应的叙述正确的是 ( )
 A.
A.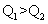
 B.生成物总能量均高于反应物总能量
B.生成物总能量均高于反应物总能量
 C.生成1molHCl气体时放出
C.生成1molHCl气体时放出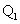 热量
热量
 D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量
D.1mol HBr(g)具有的能量大于1mol HBr(1)具有的能量

[高考预测]
纵观2010年高考考纲和近几年高考试题,化学反应与能量的内容是历年高考的重要知识点之一,备受命题者的青睐和关注。《考试大纲》要求注重理论联系实际,主要突出在能源、环保、化学工业等问题。理解反应热、燃烧热和中和热等概念;能正确书写热化学方程式。高考中有关试题以判断热化学方程式的书写是否正确、比较反应热的大小等为主,有关化学反应中的能量变化题型,在高考中以选择题为主。2010年命题方向:新能源的开发、由键能计算反应热和运用盖斯定律计算反应热等。
测试题
1.基本概念:
⑴反应热:在化学反应过程中放出或吸收的热量。反应热用符号“ΔH”表示。单位“kJ/mol”。
⑵吸热反应和放热反应:
在化学反应过程中,通常用E反表示反应物所具有的总能量,E生表示生成物所具有的总能量。
①若E反 > E生,为放热反应;当△H 为“-”或△H < 0。
②若E反 < E生,为吸热反应;当△H 为“+”或△H > 0。
2.中和热的测定
(1)实验步骤:
①保温装置的准备:大烧杯底部垫泡沫塑料(或纸条)使放入的小烧杯口与大烧杯口相平。在大小烧杯之间也同时填满碎泡沫塑料或纸条,大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。

②用量筒量取50ml,0.50moL/L盐酸,倒入小烧杯中,并用温度计测量其温度。(tHCl)
③另取一量筒量取50ml,0.55mol/L NaOH溶液,用温度计测量NaOH溶液的温度:(tNaOH)
④将量筒内的NaOH溶液全部倒入盛有HCI的小烧杯中,用玻璃搅棒轻轻搅动溶液,准确记录混合溶液的最高温度(t2)。
⑤计算:起始温度t10C=(tHCl+tNaOH)/2 , 终止温度t20C ,温度差=(t2-t1)0C
(2)注意的几个问题:
①作为量热器的仪器装置,其保温隔热的效果一定要好。因此可以用保温杯来做,也可按课本中方法做,一定要使小烧杯口与大烧杯口相平,这样可以减少热量的损失。
②盐酸和NaOH溶液浓度的配制须准确,且NaOH溶液的浓度须稍大于盐酸的浓度。为使测得的中和热更准确,因此HC1和NaOH溶液的浓度宜小不宜大,如果浓度偏大,则溶液中阴、阳离子间的相互牵制作用就大,表观电离度就会减小.这样酸碱中和时产生的热量势必要用去一部分来补未电离分子的离解热,造成较大误差。
③宜用有O.1分刻度的温度计,且测量应尽可能读准,并估读到小数点后第二位。温度计的水银球部分要完全浸没在溶液中,而且要稳定一段时间后再读数,以提高所测温度的精度。
④不宜用弱酸、弱碱代替强酸、强碱,来测中和热,否则会因中和过程中电离吸热,使测得的中和热数值不准确。
⑤实验操作时动作要快。以尽量减少热量的散失。
⑥实验过程要至少重复两次,取测量所得数据的平均值作为计算依据,可以使中和热测定尽量准确。
例2、(2009·四川)9.25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是
A.2H+(aq) +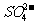 (aq)+
(aq)+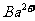 (aq)+2OH
(aq)+2OH (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H O(1);
O(1); H=
H= 57.3 kJ/mol
57.3 kJ/mol
B.KOH(aq)+ H
H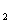 SO4(aq)=
SO4(aq)=  K
K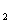 SO4(aq)+H
SO4(aq)+H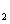 O(I);
O(I);  H=
H=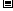 57.3kJ/mol
57.3kJ/mol
C.C8H18(I)+ 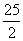 O
O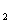 (g)=8CO
(g)=8CO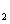 (g)+ 9H
(g)+ 9H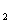 O;
O;  H=
H=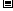 5518 kJ/mol
5518 kJ/mol
D.2C8H18(g)+25O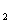 (g)=16CO
(g)=16CO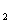 (g)+18H
(g)+18H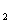 O(1);
O(1);  H=
H=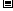 5518 kJ/mol
5518 kJ/mol
[答案]B
[解析]A项中因有BaSO 4沉淀的生成而使反应热大于中和热;C项中生成物水为气态,D项中辛烷的物质的量不是1mol,所以ACD错误。
4沉淀的生成而使反应热大于中和热;C项中生成物水为气态,D项中辛烷的物质的量不是1mol,所以ACD错误。
考点三 、盖斯定律的应用
盖斯定律:当某一物质在定温定压下经过不同的反应过程,生成同一物质时,无论反应是一步完成还是分几步完成,总的反应热是相同的。即反应热只与反应始态(各反应物)和终态(各生成物)有关,而与具体反应的途径无关。应用盖斯定律进行简单计算,关键在于设计反应过程,同时注意:
⑴ 当反应式乘以或除以某数时,△H也应乘以或除以某数。
⑵ 反应 式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算。
式进行加减运算时,△H也同样要进行加减运算,且要带“+”、“-”符号,即把△H看作一个整体进行运算。
⑶ 通过盖斯定律计算比较反应热的大小时,同样要把△H看作一个整体。
⑷ 在设计的反应过程中常会遇到同一物质固、液、气三态的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
⑸ 当设计的反应逆向进行时,其反应热与正反应的反应热数值相等,符号相反。
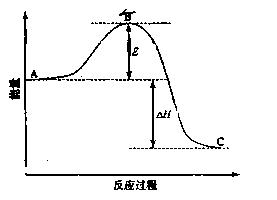
例3、(2009·宁夏)28、2SO2
(g) + O2(g)  2SO3(g) 反应过程的能量变化如图所示。已知青1mol SO2(g)氧化为1mol SO3(g)的H = -99 kJ·mol-1。
2SO3(g) 反应过程的能量变化如图所示。已知青1mol SO2(g)氧化为1mol SO3(g)的H = -99 kJ·mol-1。
请回答下列问题:
(1)图中A、C分别表示____、___ _,E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________,理由是_____________;
_,E的大小对该反应的反应热有无影响?____。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________,理由是_____________;
(2)图中△H=_____________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式___________;
(4)如果反应速率V(SO2)为0.05 mol·L-1·min-1,则V(O2)=____mol·L-1·min-1、V(SO3)= ____mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(S)生成3 molSO3(g)的△H_______(要求计算过程)。

SO2(g) + 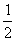 O2(g) = SO3(g) H2=-99 kJ·mol-1
O2(g) = SO3(g) H2=-99 kJ·mol-1
3S(s) + 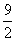 O2(g) = 3SO3(g) H2=(H1+H2)×3
O2(g) = 3SO3(g) H2=(H1+H2)×3 -1185 kJ·mol-1
-1185 kJ·mol-1
[解析](1)图中A、C分别表示反应物能量和生成物能量,由于△H等于生成物能量之和减去反应物能量之和,与活化能大小无关。催化剂能改变化学反应的历程,使活化能降低。
(2)图中表示 2mol二氧化硫气体和1mol氧气生成2mol三氧化硫气体的焓变,故△H=-198 KJ·mol-1. 。
(3)此问考查学生对催化剂概念的理解,并能正确的书写一些氧化还原方程式。
(4)化学方程式中各物质的速率之比等于化学计量数之比。
(5)由硫燃烧热热化学方程式利用盖斯定律,很容易写出。
考点四、放热反应与吸热反应
1.中和热
⑴定义:在稀溶液中,酸和碱发生中和反应而生成1mol H2O,这时的反应热叫做中和热。
⑵注意事项
中和反应的实质是H+和OH-反应生成H2O。若反应过程中有其他物质生成(如生成沉淀或弱电解质),则其反应热不等于中和热。
⑶对于强酸强碱的稀溶液反应,其中和热基本上是相等的。都约为57.3 kJ/mol
⑷对于强酸与弱碱或弱酸与强碱的反应,中和热一般低于57.3 kJ/mol。因为弱电解质的电离属于吸热反应。
1.燃烧热
⑴定义:在101 kPa时,1 mol 物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
⑵注意事项
①燃烧热是以1mol物质完全燃烧所放出的热量来定义的,因此在书写燃烧热的化学方程式时,一般以燃烧物前系数为1的标准来配平其余物质的化学计量数。
②燃烧产物必须是稳定的氧化物,例如C→CO2,H→H2O(l)等。
⑶燃料的充分燃烧
①化石燃料主要包括:煤、石油、天然气以及它们的产品等。
②可燃物的燃烧条件是:温度达到着火点、与氧气充分接触。
③充分燃烧的必要条件是:氧气要充足、可燃物与氧气接触面要大。实施方案:故体燃料粉碎,或 液化、汽化。
液化、汽化。
④不充分燃烧的危害是产热少、浪费资源、污染环境。
⑷化石燃料提供能量的弊端以及预防措施:
①弊端:化石燃料为不可再生能源、燃烧产物中含有SO2造成环境污染、CO2引起温室效应。
②预防措施:开发新能源、对燃料进行脱硫或固硫处理。
考点二、中和热
34.(9分)在全球变暖的大背景下,低碳经济受到越来越多国家的关注。下图是生态系统碳循环的部分过程,其中甲、乙、丙表示生态系统中的三种成分。试分析
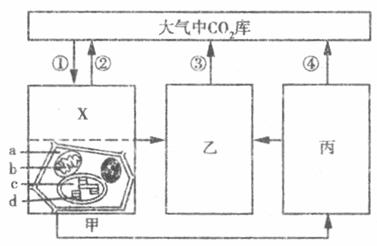
(1)《联合国气候变化框架公约》将“从大气中清除二氧化碳的过程、活动和机制”称之为“碳汇”,图中能表示“碳汇”的过程是 (用图中数字序号表示),这一过程主要发生在甲图中 处(在a~d中选择)。
(2)X与甲图细胞所示生物类群的能量来源不同,X代表的生物能量来源为 ,X的细胞结构的主要特点是 ,要从土壤中选择出该生物时培养基中应 (填加或不加)有机碳源。
(3)生态系统中,乙的成分为 。能降低温室效应的成分是 ,理由是 (2分)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com