
31.(13分)[化学--有机化学基础]
A是衡量石油化工发展水平的标志物质,F的化学式为C7H8O,K是一种常用的药用有机物,合成路线如图所示:
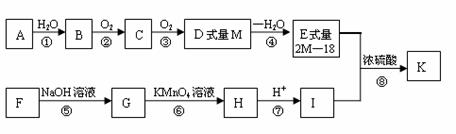
①有机物F和I都能与FeCl3发生显色反应,且苯环上的取代基处于邻位;
②有机物K只含碳、氢、氧三种元素且式量小于200,氧元素的质量分数为35.6%。请回答:
(1)写出A、F的结构简式:A ,F 。
(2)反应①~⑧中,属于加成反应的有 (填序号),反应⑤作用 。
(3)写出两种I的同分异构体(要求互不同类) , 。
(4)写出反应⑧的化学方程式 。
30.(13分)[化学一物质结构与性质]
A、B、M、X、Y、Z是元素周期表中的前20号元素.且原子序数依次增大。已知它们的部分化台物的性质如下表所示
|
A的最简单氢化物 |
B的最简单氢化物 |
M的最简单氢化物 |
X的氧化物 |
Y的最简单氢化物 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
分子呈正四面体构型 |
对应水化物为最强酸 |
回答下列问题
(1)写出X原子的电子排布式 。
(2)A、B、M电负性由大到小的排列顺序为 。
(3)Y的最简单氢化物中,Y原子的杂化形式是 。
(4)B的最简单氢化物分子的空间构型是 ,属于 分子(填“极性”或“非极性”)。
(5)比较熔点高低:A最高价氧化物的熔点 Y最高价氧化物的熔点。
(6)判断沸点高低:M氢化物的沸点 Z氢化物的沸点,原因是 。
29.(物理--选修3-5)(共2小题, 每题6分,共12分。每小题只有一个选项符合题意)
(1)月球土壤里大量存在着一种叫做“氦3(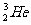 )”的化学元素,将可作为地球发电燃料.即利用氘和氦3发生核聚变反应,释放能量进行发电.关于“氦3”与氘核聚变反应,下列说法中正确的是
。(填选项前的字母)
)”的化学元素,将可作为地球发电燃料.即利用氘和氦3发生核聚变反应,释放能量进行发电.关于“氦3”与氘核聚变反应,下列说法中正确的是
。(填选项前的字母)
A.生成1 个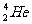 核,并释放1 个电子
核,并释放1 个电子
B.释放能量,出现质量亏损,所以生成物的总质量数减少
C.目前核电站普遍利用的就是这种核聚变反应
D.核聚变反应需要一定条件才能发生,如高温
 (2)如图所示:材料的种类未定,但是质量一定相等的A、B两个球,原来在光滑水平面上沿同一直线相向做匀速直线运动,A球的速度是6m/s,B球的速度是-2m/s,不久A、B两球发生了对心碰撞。对于该碰撞之后的A、B两球的速度可能值,某实验小组的同学们做了很多种猜测,下面的哪一种猜测结果一定无法实现的是
。(填选项前的字母)
(2)如图所示:材料的种类未定,但是质量一定相等的A、B两个球,原来在光滑水平面上沿同一直线相向做匀速直线运动,A球的速度是6m/s,B球的速度是-2m/s,不久A、B两球发生了对心碰撞。对于该碰撞之后的A、B两球的速度可能值,某实验小组的同学们做了很多种猜测,下面的哪一种猜测结果一定无法实现的是
。(填选项前的字母)
A.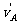 =-2m/s,
=-2m/s, =6m/s
B.
=6m/s
B. =2m/s,
=2m/s, =2m/s
=2m/s
C. =lm/s,
=lm/s, =3m/s
D.
=3m/s
D. =-3m/s,
=-3m/s, =7m/s
=7m/s
27.(18分)已知某植物的胚乳非糯(H)对糯(h)为显性,植株抗病(R)对感病(r)为显性。某同学以纯合的非糯感病品种为母本,纯合的糯抗病品种为父本进行杂交实验,在母本植物上获得的F1种子都表现为非糯。在无相应病原体的生长环境中,播种所有的F1种子,长出许多的F1植物,然后严格自交得到F2种子,以株为单位保存F2种子,发现绝大多数F1植株所结的F2种子都出现糯与非糯的分离,而只有一株F1植株(A)所结的F2种子全部表现为非糯,可见这株F1植株(A)控制非糯的基因是纯合的。
请回答:
⑴ 从理论上说,在考虑两对性状的情况下,上述绝大多数F1正常自交得到的F2植株的基因型有_________种,表现型有___________种。
⑵ 据分析,导致A植株非糯基因纯合的原因有两种:一是母本自交,二是父本的一对等位基因中有一个基因发生突变。为了确定是哪一种原因,可以分析F2植株的抗病性状,因此需要对F2植株进行处理。这种处理是____________________________________________。如果是由于母本自交,F2植株的表现型为______________________________________。其基因型是__________________________;如果是由于父本控制糯性的一对等位基因中有一个基因发生突变,F2植株的表现型为______________________,其基因型为_______________。
⑶ 如果该同学以纯合的糯抗病品种为母本,纯合的非糯感病品种为父本,进行同样的实验,出现同样的结果,即F1中有一株植株所结的F2种子全部表现为非糯,则这株植株非糯基因纯合的原因是_______________________________,其最可能的基因型为______________。
(选考部分)
第Ⅱ卷选考部分共5题,共35分。其中,第28、29题为物理题,第30、31题为化学题,考生从两道物理题、两道化学题中各任选一题作答,若答28、29题都作答,则按第28题计分,若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卷选答区域的指定位置上。
26.Ⅰ.(12分)为研究促甲状腺激素(TSH)分泌的影响因素,研究者从刚宰杀的大白
鼠体内分离新鲜的下丘脑和脑垂体。然后把这些结构单独或一起培养于含有或不
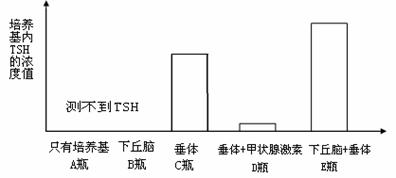 含有甲状腺激素的培养基中,培养后测定培养基内TSH的浓度,结果如下:
含有甲状腺激素的培养基中,培养后测定培养基内TSH的浓度,结果如下:
(1)在上述实验中设置A瓶的目的是____________________________。
(2)根据图中信息可知:
D瓶与A、C瓶比较说明:_________________________________。
E瓶与A、C瓶比较说明:_________________________________。
(3)人类TSH为一种糖蛋白,糖蛋白必须经内质网和高尔基体进一步加工合成。通
过转基因技术,可以使人的TSH基因得以表达的受体细胞是( )
A.大肠杆菌 B.酵母菌 C.T4噬菌体 D.质粒DNA
(4)如果研究者想进一步研究在活体实验条件下,验证甲状腺激素含量对TSH分泌
的影响,应如何设计实验?并预期实验结果。
实验材料:实验大白鼠、甲状腺激素、注射器及其它必需的材料和器具。
实验步骤:
第一步: 挑选挑生长期、大小、性别一致的实验大白鼠各10只随机分成两组,编号A、B;
第二步:A组______________________;B组______________________。
第三步:一段时间后,___________________________________
预期实验结果:___________________________________________
(5)依照培养基培养和活体实验结果,请画出甲状腺、垂体和下丘脑三者与相关激
素的关系图
Ⅱ(10分)
下图1为高等绿色植物叶肉细胞中的部分代谢示意图;图2为某植物在夏季晴朗
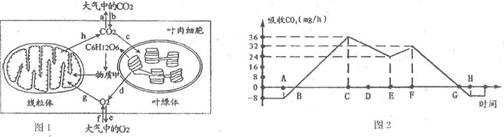 一天,测定绿色植物对C02的吸收速率并绘制成的相应曲线。据图回答:
一天,测定绿色植物对C02的吸收速率并绘制成的相应曲线。据图回答:
⑴ 图1中的物质甲是 ,该物质彻底氧化分解合成ATP最多的阶段进行的场所是 。
⑵ 图2中C点对应图l中O2的扩散途径有 (以字母表示)。影响F-G段光合速率主要环境因素是 。
⑶ 小麦处于灌浆期间若遇连阴天气,则图2中曲线B-G段与横坐标围成的面积将 。
25.(15分)
我国规定:室内甲醛含量不得超过0.0 8mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。 [查阅资料]KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。 4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O 2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O [实验一]
按如图所示装置进行采样
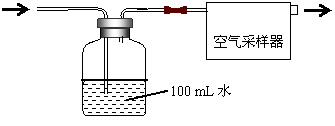
(1)由图可知甲醛的物理性质为
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可) 。
设置空气采集器为恒定流量0.5 L/min,采集20min。
[实验二]
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用。
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98 mL。计算该居室内空气中甲醛的浓度为 mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将
(填“偏大”、“无影响”、“偏小”)
[实验三]
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
|
环境温度/℃ |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
|
显色时间/min |
45 |
30 |
15 |
13 |
10 |
7 |
5 |
(7)由该表可以得出的结论是
(8)请用化学反应原理解释
24. (16分)应用化学反应需要研究化学反应的条件、限度和速率。
(1) 已知反应:Br2+2Fe2+=2Br-+2Fe3+ ,向10 mL 0.1 mol·L-1的FeBr2溶液中通入0.001 mol Cl2,反应后,溶液中除含有Cl-外,还一定有 (填序号)。
① 含Fe2+,不含Fe3+② 含Fe3+,不含Br-③ 含Fe3+,还含有Br-
(2) 773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。

① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ 下列与催化剂有关的说法中,正确的是 (填字母序号)。
a. 使用催化剂,使反应CO(g)+2H2(g) CH3OH(g) ΔH>-91 kJ·mol-1
CH3OH(g) ΔH>-91 kJ·mol-1
 b. 使用催化剂, 能够提高反应物转化率
b. 使用催化剂, 能够提高反应物转化率
c. 使用催化剂,不能改变反应的平衡常数K
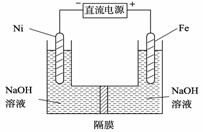
(3) 高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Ni作 (填“阴”或“阳”) 极;
②Ni电极的电极反应式为: 。
(4) 氧化还原反应中实际上包含氧化和还原两个过程。下面是HNO3发生的一个还原过程的反应式:NO-3+4H++3e-→NO+2H2O
① KMnO4、HCl、Fe(NO3)2、CuO、KI五种物质中的 (填化学式)能使上述还原过程发生。
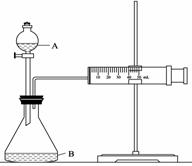
② 欲用下图装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测定 推(计)算反应速率。
23.(15分)A、B、C、D、E、F是原子半径依次减小的短周期元素,A、C两元素形成的化合物是厨房中最常用的调味品, A、B、C的最高价氧化物对应的水化物两两间均能反应生成盐和水;D元素的同位素之一被用来作为相对原子质量和阿伏加德罗常数的标准;E元素能形成多种同素异形体,其中一种是导致许多食品、药品变质的气体;F元素的氧化物是许多有机物燃烧的液态生成物。据此回答: (1)A、C、E按原子个数之比1 :1 :1形成的化合物是一种常见的消毒剂,将该消毒剂的水溶液滴在pH试纸上,可观察到现象是 ,原因是 。
(2)我国首创的海洋电池以B的单质为负极,铂网为正极,空气做氧化剂,海水做电解质溶液。电池的正极反应式为 ,电池总反应的化学方程式为 。
(3)C的最高价氧化物为无色液体,0.25 mol 该物质与一定量水混合得到一种稀溶液,并放出Q kJ 的热量。写出该反应的热化学方程式: ____________________________________。
(4)在1 L的密闭容器中,充入1 mo1DE和1 mo1 F2E (g),于850℃时进行化学反应:DE (g) + F2E (g) DE2(g)
+ F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
DE2(g)
+ F2(g) △H<0,达平衡时,有50%的DE转化为DE2。在相同温度下,将1 mo1DE和4 mo1 F2E (g)充入同样的容器中,记录0~8分钟内测得容器内各物质的物质的量如下表。t分钟时为改变条件后达平衡时所测得的数据。下列说法正确的是
|
时间/min |
n(DE)/ mo1 |
n(F2E)/mo1 |
n(DE2)/
mo1 |
n(F2)/ mo1 |
|
0 |
1 |
4 |
0 |
0 |
|
4 |
0.25 |
3.25 |
0.75 |
0.75 |
|
6 |
n1 |
n2 |
n3 |
n4 |
|
8 |
n1 |
n2 |
n3 |
n4 |
|
t |
0.15 |
3.15 |
0.85 |
0.85 |
①反应在第4 min时,v(正) v(逆)(填“>”、“=”或“<”)。
②8分钟时,混合气体中DE2的体积分数为 。
③t分钟时,反应所处的温度 850℃(填“>”、“=”或“<”)。
22.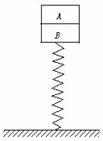 (20分)A、B两木块叠放在竖直轻弹簧上,如图所示,已知木块A、B质量分别为0.42 kg和0.40 kg,弹簧的劲度系数k=100 N/m ,若在木块A上作用一个竖直向上的力F,使A由静止开始以0.5 m/s2的加速度竖直向上做匀加速运动(g=10 m/s2).
(20分)A、B两木块叠放在竖直轻弹簧上,如图所示,已知木块A、B质量分别为0.42 kg和0.40 kg,弹簧的劲度系数k=100 N/m ,若在木块A上作用一个竖直向上的力F,使A由静止开始以0.5 m/s2的加速度竖直向上做匀加速运动(g=10 m/s2).
(1)使木块A竖直做匀加速运动的过程中,力F的最大值;
(2)若木块由静止开始做匀加速运动,直到A、B分离的过
程中,弹簧的弹性势能减少了0.248 J,求这一过程F对木块做的功.
21.(19分)如图甲所示,长度为L的金属板P、Q水平放置,两板间的距离为L/2,用直导线将P、Q金属板与电阻R0相连,上、下两水平直导线间的距离为L,在距左端为L的域有均匀分布但随时间按图乙所示规律变化的磁场B(t)(零时刻磁感应强度大小为B0,并规定方向垂直纸面向里为正方向),在P、Q金属板间有磁感应强度大小为B0、方向垂直纸面向外的匀强磁场,重力加速度为g。
(1)一带负电小球,带电荷量为q,从P、Q金属板的右端中央O点以速度v水平射入两板间,若带电小球的质量m=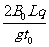 ,试分析说明小球在P、Q金属板间将怎样运动。
,试分析说明小球在P、Q金属板间将怎样运动。
(2)对第(1)问所述的情况,要使带电小球能从P、Q金属板间左侧射出,速度v应满足什么条件?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com