
10.(NH4)2SO4在高温下分解,产物是SO2、H2O、N2和NH3。在该反应的化学方程式中,
化学计量数由小到大的产物分子依次是( )
A.SO2、H2O、N2、NH3 B.N2、SO2、H2O、NH3
C.N2、SO2、NH3、H2O D.H2O、NH3、SO2、N2
9. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌
没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
8. 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反
应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2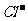
B.x=0.6a,2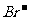 + Cl2=Br2+2
+ Cl2=Br2+2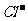
C.x=a,2Fe2++2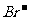 +2Cl2=Br2+2Fe3++4
+2Cl2=Br2+2Fe3++4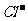
D.x=1.5a,2Fe2++4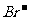 +3Cl2=2Br2+2Fe3++6
+3Cl2=2Br2+2Fe3++6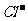
7. 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是
A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
6. 已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断正确的是( )
A.上述实验证明氧化性: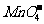 >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
4.常温下,在下列溶液中发生如下反应
① 16H++10Z-+2XO =2X2++5Z2+8H2O
=2X2++5Z2+8H2O
② 2A2++B2=2A3++2B-
③ 2B-+Z2=B2+2Z-
由此判断下列说法错误的是( )
A. 反应Z2+2A2+=2A3++2Z-可以进行
B. Z元素在①③反应中均被还原
C. 氧化性由强到弱的顺序是XO 、Z2、B2、A3+
、Z2、B2、A3+
D. 还原性由强到弱的顺序是A2+、B-、Z-、X2+
5.钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。
下列说法正确的是
A.反应①、②中电子转移数目相等
B.反应①中氧化剂是氧气和水
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
3.氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3++N2+3C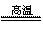 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移3mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
2.下列物质中,只有氧化性、只有还原性,既有氧化性又有还原性的顺序排列的一组是( )
A.F2、K、HCl B.Cl2、Al、H2 C.NO2、Na、Br2 D.O2、SO2、H2O
测试题
1.在氧化还原反应中,水作为氧化剂的是( )
A.C+ H2OCO2+ H2
B.3NO2+H2O══2HNO3+NO
C.2Na2O2+2H2O══4NaOH+O2↑
D.2F2+2H2O══4HF+O2
36.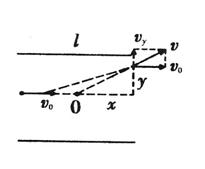 (18分)
(18分)
(1)解:由动能定理:
q =
=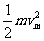 -
-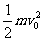 (3分)
(3分)
解出vm==5×106m/s (1分)
(用平抛运动规律算出正确答案也给全分)
(2)证明:如图,设粒子在电场中的侧移为y,则
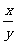 =
=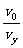 (2分)
(2分)
又l=v0t (1分)
y=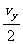 t (2分)
t (2分)
 联立解得x=
联立解得x=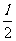 (1分)
(1分)
(用其它方式证明出来也算对)
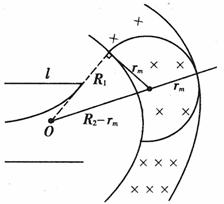
(3)解:如图,设环带外圆半径为R2,
所求d= R2-R1 (2分)
R12+rm2=(R2-rm)2 (2分)
qvmB=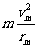 (2分)
(2分)
联立解得:d=(2- )m=O.586m (2分)
)m=O.586m (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com