
2.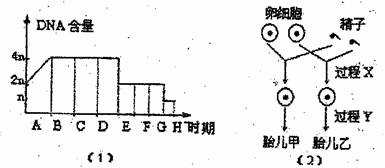 一对夫妇基因是AaBb(两对基因独立遗传)。图(1)为其一种细胞分裂方式的DNA含量变化曲线图,图(2)为该夫妇产生一对双胞胎后代的示意图。下列有关叙述错误的是 ( )
一对夫妇基因是AaBb(两对基因独立遗传)。图(1)为其一种细胞分裂方式的DNA含量变化曲线图,图(2)为该夫妇产生一对双胞胎后代的示意图。下列有关叙述错误的是 ( )
A.等位基因分离,非等位基因随机组合均发生在图(1)中的D时期
B.甲胎儿基因型为AaBb的概率为1/4
C.若该女士在A时期的DNA复制出现错误,则胎儿甲和乙均出现突变性状
D.该女士在此次生殖过程中,至少有两个卵原细胞进行减数分裂
1.人工建立一个果蝇实验种群,该种群全部个体都是含有1个隐性致死基因的杂合子。个体随机交配的情况下,观察这个实验种群的该隐性致死基因从基因库中被淘汰的过程,预测该基因的基因频率变化曲线应该是 ( )

13.答案: ① I-被氧化成I2,I2遇淀粉变蓝 2I-+ClO-+H2O=I2+Cl-+2OH-
② I2被SO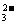 还原成I- I2+SO
还原成I- I2+SO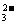 +H2O=SO
+H2O=SO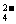 +2H++2I-
+2H++2I-
③ ClO->I2>SO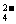
解析:淀粉溶液变蓝的原因是溶液中存在I2,可由题目提供的反应物及产物中是否有I2,推断出反应的方程式.进一步来确定I2,ClO-,SO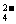 氧化性强弱。
氧化性强弱。
11.答案:6 10 24--6 5 10 3 24
解析:① 标价态。
K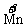 O4+
O4+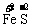 +H2SO4--
+H2SO4--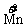 SO4+
SO4+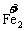 (SO4)3+
(SO4)3+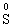 ↓+K2SO4+H2O
↓+K2SO4+H2O
② 列变化,算出一个氧化剂(或还原剂)“分子”的化合价总共降低(或升高)多少.
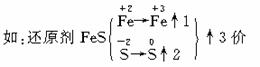
氧化剂KMnO4,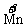 →
→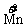 ↓5价
↓5价
③ 等升降。↑3×5(系数)5FeS;↓5×3(系数)3KMnO4并确定相应的其他元素的系数:
3KMnO4+5FeS+H2SO4--3MnSO4+Fe2(SO4)3+5S↓+K2SO4+H2O
④ 平系数。
用观察法配平其他物质的系数,一般先配盐,再配酸,最后配水,并核对氧原子数。
⑤ 验结果。
 (3)反应中氧化产物为3NaHSO4+2Na2SO4,还原产物为I2,故氧化产物与还原产物质量之比为(3×120+2×142):(2×127)=322:127
(3)反应中氧化产物为3NaHSO4+2Na2SO4,还原产物为I2,故氧化产物与还原产物质量之比为(3×120+2×142):(2×127)=322:127
7.答案:CD
解析:结合A、B两个方程式根据 氧化性、还原性强弱比较规律:得 H2O2的氧化性>Fe3+的氧化性, H2O2的还原性>Fe2+的还原性,A错;
2H2O2=2H2O+O2↑,分解过程中,Fe2+作催化剂,溶液pH值不变,B错,
H2O2分解Fe3+或Fe2+作催化剂,所以总量不变。因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确。
 解析:此题实际上是考查化学方程式的配平,(NH4)2SO4
解析:此题实际上是考查化学方程式的配平,(NH4)2SO4 NH3+N2+SO2+H2O,反应中:N:-3→0,化合价变化总数为6,S:+6→+4,化合价变化数为2,根据化合价升高和降低的总数相等,所以应在SO2前配3,(NH4)2SO4前面配3,NH3前面配4,H2O前面配6,最后计算反应前后的O原子个数相等。配平后的化学方程式为:
NH3+N2+SO2+H2O,反应中:N:-3→0,化合价变化总数为6,S:+6→+4,化合价变化数为2,根据化合价升高和降低的总数相等,所以应在SO2前配3,(NH4)2SO4前面配3,NH3前面配4,H2O前面配6,最后计算反应前后的O原子个数相等。配平后的化学方程式为:
3(NH4)2SO4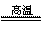 4NH3↑+N2↑+3SO2↑+6H2O。
4NH3↑+N2↑+3SO2↑+6H2O。
6.答案:A
解析:本题特别关注D选项。题中的有关反应为①2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O(生成的黄绿色气体为Cl2);②Cl2+2FeCl2====2FeCl3(FeCl3溶液为黄色);③2FeCl3+2KI====2FeCl2+2KCl+I2(I2遇淀粉变蓝色)。以上三个反应都属于氧化还原反应,根据氧化性:氧化剂>氧化产物的规律,可知A正确、B错误、C错误。实验②只能证明Fe2+具有还原性,D错误。
5.答案:A
解析:①②反应中消耗O2的量相等,两个反应也仅有O2作为氧化剂,故转移电子数是相等的,A项正确。①中H2O的H、O两元素的化合价没有变,故不作氧化剂,B项错;铜和钢构成原电池,腐蚀速度加快,C项错;钢铁是铁和碳的混合物,在潮湿的空气的中易发生吸氧腐蚀,属于电化学腐蚀,故D项错
13. ① 在淀粉碘化钾溶液中,滴加少量次氯酸钠溶液,立即会看到溶液变蓝色,这是因为_____________,离子方程式为____________________。
② 在碘和淀粉形成的蓝色溶液中,滴加亚硫酸钠溶液,发现蓝色逐渐消失,这是因为__________________,离子方程式是____________________。
③对比①和②实验所得的结果,将I2、ClO-、SO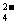 按氧化性由强到弱的顺序排列为___________________。
按氧化性由强到弱的顺序排列为___________________。
 4.答案: B
4.答案: B
解析:根据有关规律,在同一反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,可得出氧化性:XO >Z2>B2>A3+
>Z2>B2>A3+
12. 智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式为:2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)反应中_____________元素被氧化,_____________是氧化剂。
(2)用短线标出电子转移方向和总数。
(3)反应产物中,所得氧化产物与还原产物质量之比为_____________。
11.配平化学方程式
KMnO4+FeS+H2SO4--MnSO4+Fe2(SO4)3+S↓+K2SO4+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com