
2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)
(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色
(2)金属 + 酸 → 盐 + 氢气
(3)金属氧化物 + 酸 → 盐 + 水
(4)碱 + 酸 → 盐 + 水
(5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件)
1、浓盐酸、浓硫酸的物理性质、特性、用途
|
|
浓盐酸 |
浓硫酸 |
|
颜色、状态 |
“纯净”:无色液体 工业用盐酸:黄色(含Fe3+) |
无色粘稠、油状液体 |
|
气味 |
有刺激性气味 |
无 |
|
特性 |
挥发性 (敞口置于空气中,瓶口有白雾) |
吸水性 脱水性 强氧化性 腐蚀性 |
|
用途 |
①金属除锈 ②制造药物 ③人体中含有少量盐酸,助消化 |
①金属除锈 ②浓硫酸作干燥剂 ③生产化肥、精炼石油 |
 酸是由氢元素和酸根组成的化合物
如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
酸是由氢元素和酸根组成的化合物
如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱是由金属元素和氢氧根组成的化合物 如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)
盐是由金属元素元素(或铵根)和酸根组成的化合物 如:氯化钠、碳酸钠
酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)
3、配制一定溶质质量分数的溶液
(1)用固体配制:
①步骤:计算、称量、溶解
②仪器:天平、药匙、量筒、滴管、烧杯、玻璃棒
(2)用浓溶液稀释(稀释前后,溶质的质量不变)
①步骤:计算、量取、稀释
②仪器:量筒、滴管、烧杯、玻璃棒
《酸和碱》知识点
2、在饱和溶液中:
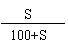 溶质质量分数C%=
× 100%(C <
S)
溶质质量分数C%=
× 100%(C <
S)
1、公式:
 溶质质量分数=
× 100%
溶质质量分数=
× 100%
3、混合物的分离
(1)过滤法:分离可溶物 + 难溶物
(2)结晶法:分离几种可溶性物质
 结晶的两种方法 蒸发溶剂,如NaCl(海水晒盐)
结晶的两种方法 蒸发溶剂,如NaCl(海水晒盐)
降低温度(冷却热的饱和溶液,如KNO3)
2、气体的溶解度
(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素: ①气体的性质 ②温度(温度越高,气体溶解度越小)
③压强(压强越大,气体溶解度越大)
1、固体的溶解度
(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:
在20℃时,在100克水中最多能溶解36克NaCl
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度
 大多数固体物的溶解度随温度升高而升高;如KNO3
大多数固体物的溶解度随温度升高而升高;如KNO3
少数固体物质的溶解度受温度的影响很小;如NaCl
极少数物质溶解度随温度升高而降低。如Ca(OH)2
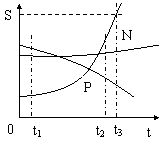
(4)溶解度曲线
|
|
|
|
|
|
(5)从A溶液中获取A晶体可用降温结晶 的方法获取晶体。
(6)从A溶解度是 80g 。
(7)t2℃ 时A、B、C的饱和溶液各W克,降温到t1℃
会析出晶体的有A和B 无晶体析出的有 C ,所得溶液中溶质的质量分数由小到大依次为 A<C<B
(8)除去A中的泥沙用 过滤 法;分离A与B(含量少)的混合物,用 结晶 法
3、饱和溶液、不饱和溶液
(1)概念:
(2)判断方法:看有无不溶物或继续加入该溶质,看能否溶解
(3)饱和溶液和不饱和溶液之间的转化

注:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低
②最可靠的方法是:加溶质、蒸发溶剂
(4)浓、稀溶液与饱和不饱和溶液之间的关系
①饱和溶液不一定是浓溶液
②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液
③在一定温度时,同一种溶质的饱和溶液一定要比它的不饱和溶液浓
(5)溶解时放热、吸热现象
溶解吸热:如NH4NO3溶解
溶解放热:如NaOH溶解、浓H2SO4溶解
溶解没有明显热现象:如NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com