
2.核外电子排布特点归纳
(1)前18号元素排布的特点
①原子核中无中子的原子1 1H
②最外层有一个电子的元素H、Li、Na
③最外层有两个电子的元素Be、Mg、He
④最外层电子数等于次外层电子数的元素为Be、Ar
⑤最外层电子数是次外层电子数2倍的元素是C;是次外层电子数3倍的元素是O;是次外层电子数4倍的是Ne
⑥电子层数与最外层电子数相等的元素H、Be、Al
⑦电子总数为最外层电子数2倍的是Be
⑧次外层是最外层电子数2倍的元素是Li、Si
⑨内层电子总数是最外层电子数的2倍的是Li、P
(2)核外电子数相同的微粒
|
|
核外电子总数为10个电子的微粒 |
核外电子总数为18个电子的微粒 |
核外电子总数及质子总数都相同的离子 |
|
分子 |
Ne、HF、H2O、NH3、CH4 |
Ar、F2、HCl、H2S、PH3、SiH4、CH3CH3、CH3OH、N2H4 、H2O2 |
|
|
阳离子 |
Na+、Mg2+、Al3+、NH4+、H3O+ |
K+、Ca2+ |
Na+、NH4+、H3O+ |
|
阴离子 |
N3-、O2-、F-、 OH-、NH2- |
P3-、S2-、Cl-、HS- |
F-、OH-、NH2- 或Cl-、HS- |
1.核外电子排布排布的规律
(1)电子层的划分
|
电子层数 |
1[来
|
2 |
3 |
4 |
5 |
6 |
7 |
|
符 号 |
K |
L |
M |
N |
O |
P |
Q |
|
离核距离 |
近  远 远 |
||||||
|
能量高低 |
低  高 高 |
(2)核外电子的排布规律
①各电子层最多容纳的电子数是2 n2(n表示电子层数)。
②最外层电子数不超过8个(K层是最外层时最多不超过2个);次外层电子数不超过18个;倒数第三层不超过32个。
③核外电子总是先排布在能量最低的电子层上,然后由里往外从能量低的电子层逐步向能量高的电子层排布(即排满K层再排L层,排满L层再排M层)。
3.构成原子或离子微粒间的数量关系:
(1)质子数=核电荷数=核外电子数=原子序数
(2)质量数=质子数+中子数
(3)质子数=阳离子的核外电子数+阳离子所带电荷数
(4)质子数=阴离子的核外电子数-阴离子所带电荷数
(5)原子的质量数≈该同位素原子的相对原子量
(6)元素的质量数≈该元素的平均相对原子量
考点二、原子的核外电子排布
2.原子结构的表示方法
(1)原子结构示意图:表示原子的核电荷数和核外电子数在各电子层排布的图示(圆圈表示原子核,圆圈里面的数字表示核电荷数,“+”表示质子带正电,半弧表示电子层,半弧上的数字表示该层上的电子数)。如Cl原子:
(2)原子组成表示式:A ZX,其中X为原子符号,A为质量数,Z为质子数,A-Z为中子数。
(3)电子式:在元素符号周围用“· ”或“×”表示最外层电子的图示。
[考点回顾]
考点一、原子的构成
 质子 → 决定元素种类
质子 → 决定元素种类
 原子核 → 质量数
原子核 → 质量数
1.原子A ZX 中子 → 决定同位素
 电子数 → 最外层电子数 → 化学性质
电子数 → 最外层电子数 → 化学性质
核外电子
电子排布 → 电子层数
39.(1)25
(2)[解] 根据图象分析,第4次加入盐酸后,样品中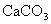 完全反应。样品中
完全反应。样品中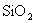 的质量为
的质量为 ,
,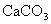 的质量:
的质量: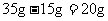 。样品中钙元素、碳元素和氧元素的质量比:
。样品中钙元素、碳元素和氧元素的质量比:
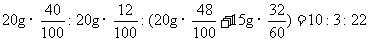
答:石灰石样品中钙元素、碳元素和氧元素的质量比为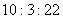 。
。
(3)[解] 由图表可知,每消耗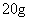 盐酸
盐酸 ,消耗
,消耗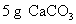 ,则
,则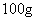 盐酸消耗
盐酸消耗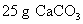 。
。
设: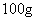 盐酸完全反应后,溶液中
盐酸完全反应后,溶液中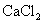 的质量为
的质量为 ,生成
,生成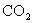 的质量为
的质量为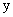 。
。
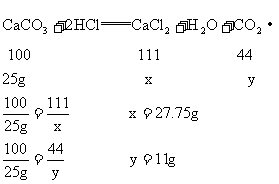
所得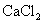 溶液的质量:
溶液的质量:
设:还需加入水的质量为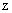 。
。
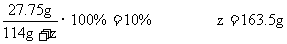
答:还需加水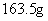 。
。
38. [解] 设:测得CO的质量为 。
。
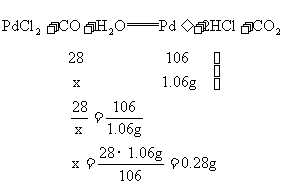 答:测得CO的质量为
答:测得CO的质量为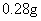 。
。
37.(1)① 和
和 ③5
③5
(3)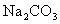
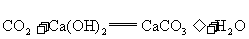
(4)①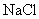 和
和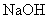
取1支试管,加入少量的D溶液,滴入几滴无色酚酞试液。若溶液变红,则D溶液为氢氧化钠溶液,第5种溶液为氯化钠溶液;若溶液无明显变化,则D溶液为氯化钠溶液,第5种溶液为氢氧化钠溶液。
②
|
实验步骤 |
实验现象和结论 |
|
取2支试管,分别加入少量的A、B溶液,然后依次加入少量的C溶液。 |
A溶液中有白色沉淀生成,A是氢氧化钙溶液;B溶液中有无色气泡逸出,B是稀盐酸。 |
36.(1)有无色气泡逸出,白色固体消失,气球微微鼓起
(2)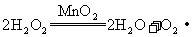
(3)溶液先变浑浊,后有部分变浑浊的液体被压入C装置中 (4)
35.(1)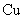 ①
① ③
③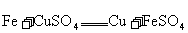
(2)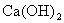
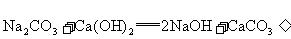 复分解反应
复分解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com