
1.常见分子的键的极性、分子构型、分子的极性
|
分子类型 |
实例 |
键的极性 |
分子构型 |
分子的极性 |
|
|
单原子分子A |
He、Ne、Ar |
- |
- |
非极性 |
|
|
双原子分子A2 |
H2、O2、N2 |
非极性键 |
直线(对称)型 |
非极性 |
|
|
双原子分子AB |
HX、CO、NO |
极性键 |
直线(不对称)型 |
极性 |
|
|
AB2 或A2B |
AB2 |
CO2、CS2 |
极性键 |
直线(对称)型 |
非极性 |
|
AB2或A2B |
H2O、SO2、H2S |
极性键 |
折线(不对称)型 |
极性 |
|
|
AB3 |
AB3 |
BF3、SO3 |
极性键 |
正三角(对称)型 |
非极性 |
|
AB3 |
NH3、PCl3 |
极性键 |
三角锥型 |
极性 |
|
|
AB4 |
CH4、CCl4 |
极性键 |
正四面体 |
非极性 |
2.用电子式表示化合物的形成过程
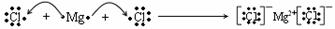 、
、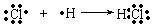
用电子式表示离子化合物的形成过程时要注意:
a.反应物要用原子的电子式表示,而不是用分子式或分子的电子式表示。生成物中的“同类项”只能分写,不能合写。
b.箭头表示电子转移的情况,说明在形成离子化合物时发生了电子的转移。
c.这样的式子也应该符合质量守恒,但是连接反应物和生成物的符号要用“ ”而不用“=”
”而不用“=”
考点十、极性分子和非极性分子
1.电子式的书写:
在元素符号周围用“·”、“×”来表示原子或离子的价电子层电子的式子,叫做电子式。
例如:原子: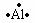 、
、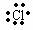 ,阳离子:Mg2+、H+、
,阳离子:Mg2+、H+、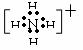 ,阴离子:
,阴离子: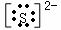 、
、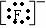 。
。
(1)原子的电子式
中性原子最外层电子数没有发生变化,书写时把最外层电子写出来,注意对称美。如硫原子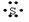
(2)离子的电子式
①阳离子的电子式
简单的阳离子的电子式就是普通的离子式;复杂的阳离子要加“[ ]”,并且标出阳离子所带的电荷。如铵根离子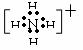
②阴离子的电子式
阴离子的电子式都要要加“[ ]”,并且标出阴离子所带的电荷。如:氯原子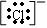 、
、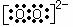
(3)化合物的电子式
①必须分清是离子化合物还是共价化合物,注意该不该用“[ ]”。
②原子或者阴阳离子的电子式必须单独书写,而且要应该隔开,保持对称美。
③注意原子、离子的最外层电子数,以及是否达到稳定结构。
如: MgF2: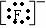 Mg2+
Mg2+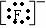 、
、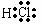 、
、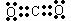
2.化学键与物质类别的关系
(1)只含非极性共价键键的物质:同种非金属元素构成的单质。如H2、N2、P4、金刚石、晶体硅;
(2)只含有极性共价键的物质:一般是不同非金属元素构成的化合物。如:HCl、NH3、CS2等;
(3)既有极性键又有非极性键的物质:如:H2O2、C2H2、C2H6、C6H6(苯);
(4)只含离子键的物质:活泼金属和活泼非金属元素形成的化合物。如:NaCl、K2S、MgBr2等。
(5)既有离子键又有非极性键的物质,如Na2O2、CaC2等。
(6)由离子键、共价键、配位键构成的物质,如:NH4Cl
(7)只含共价键而无范德瓦耳斯力的化合物,如原子晶体SiO2、SiC等。
( 8)无化学键的物质:稀有气体,如He、Ar等。
8)无化学键的物质:稀有气体,如He、Ar等。
(9)由极性键形成的非极性分子有:CO2、CS2等。
(10)都是由非金属元素形成的离子化合物为:NH4Cl 、NH4HCO3等;
考点八、化学键、分子间作用力、氢键的比较
|
|
化学键 |
分子间作用力 |
氢键 |
|
定义 |
相邻的两个或多个原子间的强烈的相互作用 |
把分子聚集在一起的作用 |
某些氢化物分子间存在的一种相互作用 |
|
范围 |
分子内或某些晶体内 |
分子间 |
HF、H2O、NH3等分子间 |
|
强度 |
比较强烈 |
比化学键弱的多 |
比分子间作用力稍强 |
|
性质影响 |
主要影响分子的化学性质 |
影响物质的熔沸点等物理性质 |
影响物质的熔沸点等物理性质 |
考点九、电子式
1.化学键的类型比较
|
|
离子键 |
共价键 |
金属键 |
|
|
极性键 |
非极性键 |
|||
|
定义 |
阴、阳离子之间的静电作用 |
不同原子间通过共用电子对所形成的相互作用 |
相同原子间通过共用电子对所形成的相互作用 |
金属阳离子和自由电子之间的静电作用 |
|
成键元素 |
活泼的金属元素与活泼的非金属元素 |
不同的非金属元素 |
相同的非金属元素 |
金属元素之间 |
|
成键微粒 |
阴、阳离子 |
原子 |
原子 |
金属阳离子与自由电子 |
|
粒子间相互作用 |
静电作用 |
共用电子对 |
共用电子对 |
静电作用 |
|
电子式举例 |
Na+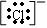 |
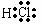 |
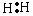 |
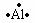 |
|
重要应用 |
是使原子互相结合成分子的主要因素 |
3.推断中常见的“突破口”
(1)周期表中特殊位置的关系
①族序数等于周期数的元素:H、Be、Al、Ge;
②族序数等于周期数2倍的元素:C、Si;
③族序数等于周期数3倍的元素:O
④周期数是族序数的2倍的元素是:Li、Ca;
⑤周期数是族序数的3倍的元素是:Na、Ba
⑥最高正价与最低负价之和为0的短周期元素是:C
⑦最高正价是最低负价绝对值3倍的元素是:S
⑧原子半径最小的元素为H。其次为F
⑨短周期中离子半径最大的是P3-
(2)常见元素及其化合物的特性
①形成化合物种类最多的元素、单质是自然界硬度最大的物质、气态氢化物中氢的质量分数最高的元素:C;
②空气中含量最多的元素、气态氢化物呈碱性的元素、化合价最多的元素:N;
③地壳中含量最多的元素、氢化物沸点最高的元素、氢化物在常温下呈液态的元素:O;
④单质在常温下呈液态的元素:非金属元素Br、金属元素 Hg
⑤最高价氧化物既能与强酸反应又能与强碱反应的元素、最高价氧化物对应水化物既是酸又是碱的元素、地壳中含量最多的金属元素:Al
⑥元素的气态氢化物和最高价氧化物对应水化物可以发生化合反应的元素是N,可以发生氧化还原反应的元素是S
⑦单质在常温下能与水反应生成气体的元素是;Na、Li、F
考点七、化学键
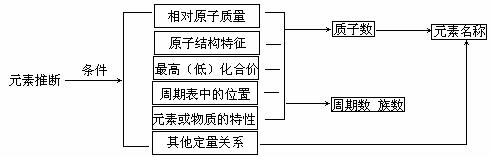
2.根据原子结构、元素周期表的知识及相关已知条件可推算原子序数、判断元素在周期表中的位置,基本思路为:
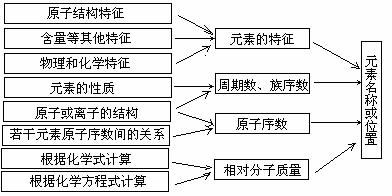
1.预测元素的性质
常见题目是给出一种不常见的主族元素或尚未发现的主族元素,推测该元素及其单质或化合物所具有的性质。
5.电子数和核电荷数都不同的,一般可通过一种参照物进行比较,如:比较Al3+与S2-的半径大小,可找出与Al3+电子数相同,与S2-同一族元素的O2-比较,Al3+<02-,且O2-<S2-,故A13+<S2-。
考点六、推断题的解题方法
4.核电荷数相同(即同种元素)形成的微粒半径大小为阳离子<中性原子<阴离子,价态越高的微粒半径越小,
如 Fe3+<Fe2+;H+<H<H-;C1<C1-。
Fe3+<Fe2+;H+<H<H-;C1<C1-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com