
33. (10分)工业生产果汁时,常常利用果胶酶破除果肉细胞壁以提高出果汁率,为研究温度对果胶酶活性的影响,某学生设计了如下实验:
(10分)工业生产果汁时,常常利用果胶酶破除果肉细胞壁以提高出果汁率,为研究温度对果胶酶活性的影响,某学生设计了如下实验:
①将果胶酶与苹果泥分装于不同试管,在10℃水浴中恒温处理10分钟(如图A)。
②将步骤①处理后的果胶酶和苹果泥混合,再次在10℃水浴中恒温处理10分钟(如图B)。
③将步骤②处理后的混合物过滤,收集滤液,测量果汁量(如图C)。
④在不同温度条件下重复以上实验步骤,并记录果汁量,结果如下表:
|
实验组 |
A |
B |
C |
D |
E |
F |
G |
H |
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
果汁量/ml |
8 |
13 |
15 |
25 |
15 |
12 |
11 |
10 |
根据上述实验,请分析回答下列问题:
(1)实验步骤①的目的是:_____________________________。
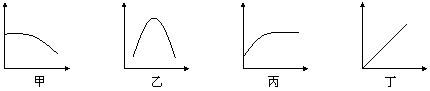 (2)如果用曲线图方式记录比较实验结果,在现有的条件下,以横坐标表示温度,纵坐标表示____________,实验操作和记录是比较切实可行的。在原材料有限的情况下,能正确表示相同时间内果胶酶的用量对果汁产量影响的曲线是____________。
(2)如果用曲线图方式记录比较实验结果,在现有的条件下,以横坐标表示温度,纵坐标表示____________,实验操作和记录是比较切实可行的。在原材料有限的情况下,能正确表示相同时间内果胶酶的用量对果汁产量影响的曲线是____________。
(3)为了使实验结果更准确,对各组实验pH的要求是_________________。
(4)若将果胶酶和苹果泥先混合再进行实验,实验结果是否准确?为什么?
_________________________________________________________。
32.(10分)甘薯和马铃薯都富含淀粉,但甘薯吃起来比马铃薯甜.为探究其原因,某兴趣小组以甘薯块茎为材料,在不同温度、其他条件相同的情况下处理30 min后测定还原糖含量.结果表明马铃薯不含还原糖,甘薯的还原糖含量见下表:
|
温度(℃) |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
|
甘薯还原糖含量(mg/g) |
22.1 |
23.3 |
25.8 |
37.6 |
40.5 |
47.4 |
54.7 |
68.9 |
45.3 |
28.6 |
(1)为了确认马铃薯不含还原糖的原因,请完成以下实验:
实验原理:① ;
② .
备选材料与用具:甘薯提取液(去淀粉和还原糖),马铃薯提取液(去淀粉),二苯胺试剂,斐林试剂,双缩脲试剂,质量分数为3%的淀粉溶液和质量分数为3%的蔗糖溶液等.
实验步骤:
第一步:取A、B两支试管,在A管中加入甘薯提取液,B管中加入等量的马铃薯提取液.
第二步:70 ℃水浴保温5 min后,在A、B两支试管中各加入 .
第三步:70 ℃水浴保温5 min后,在A、B两支试管中各加入等量斐林试剂.
第四步:沸水浴加热煮沸1-2 min.
实验结果: .
(2)马铃薯不含还原糖,但吃起来略带甜味,这是由于 的作用。
31.(12分)2007年夏季,继江苏太湖和安徽巢湖之后,蓝藻再次在污染本来就十分严重的云南滇池不可避免地爆发了,因为在几次蓝藻灾害中,我们都看到了“先污染、后治理”“边治理、边污染”所造成的严重恶果。大自然已向我们进行报复,向我们发出强烈的警示。一方面,政府十多年投入47亿元治污,另一方面,滇池周边的工厂、村庄、农田每天仍产生着大量污染源,污染速度远高于治理速度,造成滇池水体中的氮、磷浓度升高,造成水体富营养化,致使其从昔日的“高原明珠”变成了今日的“高原绿珠”。
(1)滇池蓝藻爆发时湖面漂浮着一层绿膜,有人认为这是绿藻而不是蓝藻。对此,可以通过显微镜观察细胞是否具有___________来判断。
(2)迸人夏季气温偏高是滇池蓝藻爆发的原因之一,从本质上看这是人为污染超过了滇池生态系统的___________,而温度是通过影响细胞内___________来影响蓝藻的生长。
(3)为了防止滇池水源被污染,环保部门加强对滇池上游流域沿岸工厂的监测,现怀疑某工厂是污染源之一,并对其排污口进行了检测。检测员沿河每隔100m取水样一次,共取9份并依次编号为①~⑨,已知⑤号水样正对工厂排水口。检验员对所取水样进行了如下处理:Ⅰ.检测水样中的蓝藻数量(A组);Ⅱ.滤除水样中全部蓝藻后,每份水样分为三等份,编号B、C、D,其中B、C组分别添加适量的N和P,D组不添加无机盐。然后加人等量的蓝藻,放置在阳光下若干天,再检测水样中蓝藻量,统计数据如下表(蓝藻数量,单位:百万细胞/mm3)。
|
水样编号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|
A组(原始水样) |
0.2 |
0.3 |
0.3 |
1 |
10 |
10 |
7 |
7 |
6.5 |
|
B组(添加N) |
1 |
1.5 |
2 |
2.5 |
20 |
19 |
18 |
17 |
18 |
|
C组(添加P) |
8 |
9 |
9.5 |
10 |
11 |
9.5 |
7.5 |
7.5 |
7 |
|
D组(无添加) |
0.2 |
0.2 |
0.3 |
1 |
10 |
9 |
7 |
7 |
6.5 |
请回答有关问题:
① 通过A组数据可以判断该工厂是污染源,依据是______________________。
② 进行B、C、D分组实验的目的是探究工厂排出的污染物主要是N含量超标还是P含量超标,其中D组起_____________作用。从实验结果可得出的结论是____________________。
30.(17分)某种存在于茶叶中的有机物A(C9H8O3),其分子中所含的苯环上有2个取代基,取代基上不含支链,且苯环上的一氯代物只有2种;A遇FeCl3溶液发生显色反应。F分子中除了2个苯环外,还有一个六元环。
它们的转化关系如下图:

请回答下列问题:
(1)有机物A中含氧官能团的名称是__________________________________;
(2)写出X、F的结构简式X 、F
(3)写出下列反应的化学方程式
A→B:__________________________________________________________;
M→N:_________________________________________________________;
(4)A→C的反应类型为____________,E→F的反应类型为_______________;
(5)1mol A可以和___________mol Br2反应;
(6)某营养物质的主要成分(分子式为C16H14O3)是由A和一种芳香醇R发生酯化反应生成的,则R的同分异构体中含有苯环的有___________种(不包括R);
(7)A→C的过程中还可能有另一种产物C1,请写出C1在NaOH水溶液中反应的化学方程式_____________________________________________________________。
29.( 14 分)在元素周期表中,锌(30Zn)、镉(48Cd)、汞(80Hg)同属于锌族,锌和汞在自然界中常共生,镉的金属活动性介于锌和汞之间。湿法炼锌过程中产生的铜镉渣中含有Cu、Cd、Zn等多种金属,可用于生产金属镉。镉的主要用途可以用作镍―镉电池,以及用于颜料生产,镉化合物还在PVC稳定剂、发光材料、半导体材料、杀菌剂等方面有广泛的应用。镉的生产流程如图示意如下:

请回答下列问题:
(1)镉元素位于周期表中第 周期,第 族,其原子结构示意图为 ;
(2)写出步骤①反应的离子方程式 。
(3)步骤②所加入的金属是 。
(4)步骤④用“溶液2”作电解液,镉在 极析出,该电极材料是
(5)“电解废液”中含有镉,不能直接作为污水排放。目前含镉的废水处理的方式有两种,一种是在含镉污水中加入硫化钠,沉淀镉离子,另一种是加入聚合硫酸铁和聚合氯化铝,沉淀镉离子。写出硫化钠沉淀镉离子的离子方程式 。
28.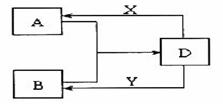 (14分)A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
(14分)A、B、D、X、Y是由短周期元素组成的化合物,其中X、Y分别是常见的强酸、强碱。它们存在如下图转化(部分生成物和水略去)。
(1)若A、B均为气体,在水溶液中反应生成正盐D,其中A是形成酸雨的主要物质。则D的化学式是 。B发生催化氧化反应的化学方程式是 。
(2)若A、B、D含有相同的金属元素,则此元素在元素周期表中的位置是 ,工业上制取该金属单质的化学方程式为: ,现将X滴入B的溶液中至过量,该过程发生的离子方程式为: 。
(3)若A为无色无味的气体,B为盐,且A、B、D三种物质含有相同元素,则A的电子式为: ,A与B溶液反应生成D的离子方程式为: 。
27.(15分)运用化学反应原理研究常见元素的单质及其化合物有重要意义。
(1)合成氨反应N2
(g)+3H2(g) 
 2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
2NH3(g),△H<0。若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不变”)。
(2)向Na2C2O4溶液加入少量石蕊,溶液显 色,请用离子方程式表示出现该现象的原因: ;
(3)pH相同的氨水和氢氧化钠,分别用蒸馏水稀释至原来溶液的100倍,则稀释后两种溶液的pH分别为m和n,则m n(选填“>”“<”“=”);
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl―NH4Cl为电解质溶液制造新型燃料电池。请写出该电池的正极反应式 。
(5)氢气燃烧热值高。实验测得,在常温常压下,4gH2完全燃烧生成液态水,放出571.6kJ热量,则表示H2燃烧热的热化学方程式为 。
(6)某温度(t℃)时,测得0.01mol・L-1的NaOH溶液的pH=11。在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va∶Vb= 。
26.(21分)如图(a)所示,一端封闭的两条平行光滑导轨相距L,距左端L处的中间一段被弯成半径为H的1/4圆弧,导轨左右两段处于高度相差H的水平面上。圆弧导轨所在区域无磁场,右段区域存在磁场B0,左段区域存在均匀分布但随时间线性变化的磁场B(t),如图(b)所示,两磁场方向均竖直向上。在圆弧顶端,放置一质量为m的金属棒ab,与导轨左段形成闭合回路,从金属棒下滑开始计时,经过时间t0滑到圆弧底端。设金属棒在回路中的电阻为R,导轨电阻不计,重力加速度为g。
⑴问金属棒在圆弧内滑动时,回路中感应电流的大小和方向是否发生改变?为什么?
⑵求0到时间t0内,回路中感应电流产生的焦耳热量。
⑶探讨在金属棒滑到圆弧底端进入匀强磁场B0的一瞬间,回路中感应电流的大小和方向。
25.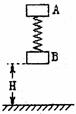 (18分) 如图所示,将质量均为m厚度不计的两物块A、B用轻质弹簧相连接。第一次只用手托着B物块于H高度,A在弹簧弹力的作用下处于静止,现将弹簧锁定,此时弹簧的弹性势能为Ep,现由静止释放A、B,B物块刚要着地前瞬间将弹簧瞬间解除锁定(解除锁定无机械能损失),B物块着地后速度立即变为O,在随后的过程中B物块恰能离开地面但不继续上升。第二次用手拿着A、B两物块,使得弹簧竖直并处于原长状态,此时物块B离地面的距离也为H,然后由静止同时释放A、B,B物块着地后速度同样立即变为0。求:
(18分) 如图所示,将质量均为m厚度不计的两物块A、B用轻质弹簧相连接。第一次只用手托着B物块于H高度,A在弹簧弹力的作用下处于静止,现将弹簧锁定,此时弹簧的弹性势能为Ep,现由静止释放A、B,B物块刚要着地前瞬间将弹簧瞬间解除锁定(解除锁定无机械能损失),B物块着地后速度立即变为O,在随后的过程中B物块恰能离开地面但不继续上升。第二次用手拿着A、B两物块,使得弹簧竖直并处于原长状态,此时物块B离地面的距离也为H,然后由静止同时释放A、B,B物块着地后速度同样立即变为0。求:
(1)第二次释放A、B后,A上升至弹簧恢复原长时的速度v1;
(2)第二次释放A、B后,B刚要离地时A的速度v2。

24. (15分)质量为M=2.5kg的一只长方体形铁箱在水平拉力F作用下沿水平面向右匀加速运动,铁箱与水平面间的动摩擦因数为μ1=0.50。这时铁箱内一个质量为m=0.5kg的木块恰好能静止在后壁上(如图所示),木块与铁箱内壁间的动摩擦因数为μ2 =0.25。设最大静摩擦力等于滑动摩擦力,取g=10m/s2。
(15分)质量为M=2.5kg的一只长方体形铁箱在水平拉力F作用下沿水平面向右匀加速运动,铁箱与水平面间的动摩擦因数为μ1=0.50。这时铁箱内一个质量为m=0.5kg的木块恰好能静止在后壁上(如图所示),木块与铁箱内壁间的动摩擦因数为μ2 =0.25。设最大静摩擦力等于滑动摩擦力,取g=10m/s2。
求:(1)木块对铁箱的压力; (2)水平拉力F的大小。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com