
14.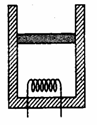 如图所示,质量为M的绝热活塞把一定质量的理想气体(不考虑
如图所示,质量为M的绝热活塞把一定质量的理想气体(不考虑
分子势能)密封在竖直放置的绝热气缸内。活塞可在气缸内无摩擦
地滑动。现通过电热丝对理想气体缓慢地加热。气缸处在大气中,
设大气压强恒定。经过一段时间后
A.气缸中气体的体积比加热前减小
B.气缸中气体的压强比加热前增大
C.活塞在单位时间内受气缸中分子撞击的次数比加热前减少
D.气缸中气体的内能和加热前一样大
13.标准状况下,将a L SO2和Cl2组成的混合气体通入100 mL 0.1 mol·L-1 Fe2(SO4)3溶液中,充分反应后,溶液的棕黄色变浅。向反应后的溶液中加入足量的BaCl2溶液,将所得沉淀过滤、洗涤、干燥后称重,其质量为11.65 g。则下列关于该过程的推断不正确的是
A.所得沉淀为0.05 mol BaSO4
B.混合气体中SO2的体积为0.448 L
C.a L混合气体的物质的量为0.04 mol
D.a的取值范围为0.672 L<a<0.896 L
12.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下图所示:
nY(g);△H=QkJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下图所示:
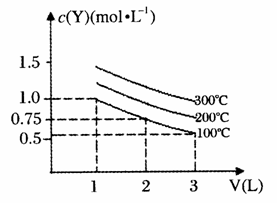
下列说法正确的是
A.m>n
B.Q<0
C.体积不变,温度升高,平衡向逆反应方向移动
D.温度不变,压强增大,Y的质量分数减少
11.在下图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹,夹在被Na2SO4溶液浸湿的滤纸条上,滤纸条的中部滴有KMnO4液滴;电源有a、b两极。若在A、B中充满KOH溶液后倒立于盛KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电,实验现象如图所示。下列说法正确的是
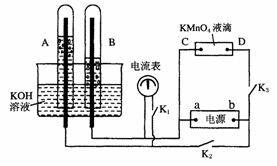
A.电源中a为正极,b为负极
B.试管A中的电极反应式为:2H++2e-=H2↑
C.一段时间后滤纸条上紫红色向C处移动
D.电解一段时间后,切断K2、K3,闭合K1,电流计的指针会发生偏转
10.a、b、c、d四种溶液,它们电离出的阳离子有Na+、Ag+、Al3+、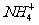 ,阴离子有Cl-、
,阴离子有Cl-、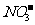 、
、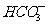 、OH-。它们有如下反应现象:(1)a+b→白色沉淀;(2)a+c→白色沉淀+无色气体;(3)a+d→白色沉淀,d过量时沉淀无变化;(4)b+d→沉淀,d过量时沉淀溶解。关于这四种溶液说法中正确的是
、OH-。它们有如下反应现象:(1)a+b→白色沉淀;(2)a+c→白色沉淀+无色气体;(3)a+d→白色沉淀,d过量时沉淀无变化;(4)b+d→沉淀,d过量时沉淀溶解。关于这四种溶液说法中正确的是
A.这四种溶液中所含溶质均为强电解质
B.相同温度下水的电离程度:c>d
C.相同温度、相同浓度时溶液的pH:c>d
D.(1)、(2)、(3)中的沉淀可能是同一种物质
9.下图为A、B两种物质间的转化关系(其中C、D是反应物,部分产物已省略)。

以下判断不正确的是
A.若A是AlCl3,则C既可以是强碱,也可以是弱碱
B.若A是碱性气体,则A和C可能发生氧化还原反应,也可能发生非氧化还原反应
C.若A→B是氧化还原反应,则C、D在上述转化过程中一定有一种为氧化剂,另一种为还原剂
D.上述变化过程中,A可以是酸、碱、盐,也可以是单质或氧化物
8.下列各组溶液,用括号内的试剂及物质问相互反应不能鉴别的一组是
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2 (FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3 (H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2 (AgNO3溶液)
D.(NH4)2SO4、MgSO4、CuSO4、AlCl3 (KOH溶液)
7.a、b、c、d、e为原子序数依次增大的五种短周期元素,下表列出了它们的一些重要参数:

以下说法正确的是
A.a、b两种元素氢化物的沸点高于同主族其它元素的氢化物,原因是它们的分子之间都存在氢键
B.e单质与c元素的最高价氧化物对应水化物反应的离子方程式为
2Al+2OH-+H2O=2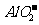 +2H2↑
+2H2↑
C.氢化物的稳定性:a>b
D.d在a的单质中燃烧,产物中阳离子的半径大于阴离子的半径
6.下列对化学概念的理解正确的是
A.NaCl、NaClO、NaHSO4、Na2O2晶体中阳离子和阴离子的个数比都是1 :1
B.在单质的晶体中可能存在原子、分子或阳离子,但不可能存在阴离子
C.共价键、离子键、范德华力和氢键是形成晶体微粒之间的四种作用力,这四种作用力可能同时存在于同一晶体中
D.不同类型晶体的熔沸点不同,根据物质的熔沸点数据即可判断其所属的晶体类型
5.已知玉米的高茎和矮茎是一对相对性状,将纯种的高茎玉米和矮茎玉米杂交,F1全为高茎。让F1个体相互授粉产生F2,再让F2中的高茎玉米相互授粉,则后代中高茎玉米和矮茎玉米的比例为
A.8 :1 B.9 :1 C.6 :1 D.3 :1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com