
3.下列句子中,语意明确、没有语病的一项是(3分) ( )
A.打击违法网站的决心决不动摇,违法者必将受到法律的应有制裁。国务院新闻办公室网络局有关负责人近日宣布,一批群众举报违法网站遭查。
B.在电影的结尾,冯导情理之外却是意料之中的来了一句:2l世纪什么最可贵--和谐!从而显示出他坚定不移的走主流路线,也标榜出其不可动摇的主流地位。
C.长安是平地起城,其选址经过缜密论证,考虑的是管辖辽阔疆域的安全需要,代表的是整个国家和整个民族的根本利益。
D.把现实中破败凋敝的骑楼搬到世博会上去做广东馆的主要造型创意,就是由于先进的广东对自己的传统文化的臣服的原因。
2.下面语段中加点的词语,使用不恰当的一项是 ( )
那位曾经因盗取莫高窟壁画而臭名昭著的兰登·华尔纳在传记里这样写他见到敦煌那些精妙绝伦的艺术形象时受到的震撼,“神佛们是那样地高深莫测,使我第一次意识到为什么我会远涉重洋横越亚美来弄清楚他们的存在。这非凡的美已让我无法使自己带着批判的眼光从事研究。我并非佛教徒,但此时却领受了一次神佛的洗礼。”敦煌就是以这样的魅力让一代又一代艺术家们趋之若鹜,甘愿相守。
A.臭名昭著 B.精妙绝伦
C.高深莫测 D.趋之若鹜
1.下列词语中加点的字,每对读音都不相同的一项是(3分) ( )
A.沆瀣一气/巷道 鞭笞/苔藓 行伍/行云流水
B.斐然成章/悱恻 嗔怒/滇池 折本/不折不扣
C.好高骛远/芜杂 淬火/猝发 起哄/哄堂大笑
D.色厉内荏/熟稔 绸缪/荒谬 载体/车载斗量
16.(13分)(2010·合肥模拟)已知SiO2、SO2和CO2都是酸性氧化物,化学性质具有一定 的相似性;Mg和Na的化学性质也具有一定的相似性。
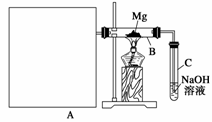
Ⅰ.用如上图所示装置进行Mg和SO2的实验,其中A是制备SO2的发生装置。
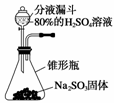
(1)选择制取SO2的合适试剂______________(填序号)。
①10%的H2SO4溶液 ②80%的H2SO4溶液
③Na2SO3固体 ④CaSO4固体
(2)写出装置B中发生的主要反应的化学方程式:
________________________________________________________________________
______________________。装置C中NaOH溶液的作用是_______________。
(3)请在图中画出制备SO2的发生装置并注明主要仪器的名称,固定仪器省略不画。
(4)你认为该装置的不足之处是
________________________________________________________________________
________________________________________________________________________。
Ⅱ.某研究性学习小组进行了“实验室制Si”的研究,他们以课本为基础,查阅资料得到 以下可供参考的信息:①工业上在高温时用C还原SiO2可制得Si ②Mg在点燃的条件 下即可与SiO2反应 ③金属硅化物与稀H2SO4反应生成硫酸盐与SiH4 ④Si和SiO2均 不与稀H2SO4反应
⑤SiH4在空气中自燃
他们在研究报告中记载着:“……选用合适的物质在适宜的条件下充分反应,再用足量 稀硫酸溶解固体产物;然后过滤、洗涤、干燥,最后称量……在用稀硫酸溶解固体产物 时,发现有爆鸣声和火花,其产率也只有预期值的63%左右。”
(5)该小组“实验室制Si”的化学方程式是
________________________________________________________________________。
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花”的原因是
________________________________________________________________________
________________________________________________________________________。
答案 (1)②③
(2)3Mg+SO22MgO+MgS(或2Mg+SO22MgO+S,Mg+SMgS) 吸收 多余的SO2,防止污染环境
(3)如图
(4)在A和B之间没有连接一干燥装置;C装置未与大气相通;在镁下方未垫一不锈钢片,
镁与玻璃管反应;未设计一防倒吸装置
(5)2Mg+SiO22MgO+Si
(6)金属镁与生成的硅继续反应生成硅化镁,硅化镁与稀硫酸反应生成的SiH4可自燃。(或 用化学方程式表示:2Mg+SiMg2Si,Mg2Si+2H2SO4===2MgSO4+SiH4↑, SiH4+2O2===SiO2+2H2O)
15.(5分)(2010·南京模拟)已知A-I有如图所示转换关系:
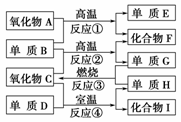
已知:①单质E可作为半导体材料;
②化合物F是不能生成盐的氧化物;
③化合物Ⅰ能溶于水呈酸性,它能够跟氧化物A起反应。
据此,请填空:
(1)化合物F是________。
(2)化合物Ⅰ是____________。
(3)反应③的化学方程式是
________________________________________________________________________。
(4)反应④的化学方程式是
________________________________________________________________________。
(5)写出Ⅰ的水溶液与A反应的方程式:
________________________________________________________________________。
解析 因单质E和化合物F分别是半导体材料和不成盐的氧化物,可考虑分别为Si 和CO,反应①的化学方程式为SiO2+2CSi+2CO↑,氧化物A为SiO2,它除了 能跟氢氟酸反应以外不跟任何酸起反应,由此判断化合物Ⅰ为HF,依次类推C为H2O、 D为F2,H为O2。
答案 (1)CO (2)HF (3)2H2+O22H2O
(4)2F2+2H2O===4HF+O2
(5)4HF+SiO2===SiF4↑+2H2O
14.(8分)(2008·广东,23)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅 的主要方法,生产过程示意图如下:
焦炭高温HCl573 K以上H21 357 K
① 写出由纯SiHCl3制备高纯硅的化学反应方程式
________________________________________________________________________
________________________________________________________________________。
② 整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式
________________________________________________________________________;
H2还原SiHCl3过程中若混入O2,可能引起的后果是
________________________________________________________________________。
(2)下列有关硅材料的说法正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料--光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液, 振荡。写出实验现象并给予解释:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析 (1)①根据原子守恒即质量守恒可以写出SiHCl3与H2反应的化学方程式。
②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,  ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必 定降低,即另一种物质是H2。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必 定降低,即另一种物质是H2。
(2)碳化硅、氮化硅为原子晶体,A、B和C都正确。玻璃是一种玻璃态物质,无固定的 熔点。盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应。因此D、E 都不正确。
答案 (1)①SiHCl3+H2Si+3HCl
②SiHCl3+3H2O===H2SiO3↓+3HCl↑+H2↑
氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3
(2)ABC
(3)现象:试管中有白色胶状沉淀生成,并且有刺激性气体生成
解释:Na2SiO3和NH4Cl均能够水解,二者相互促进,Na2SiO3水解生成 H2SiO3, NH4Cl水解产生NH3
13.(14分)(2009·全国理综Ⅰ,29)已知周期表中,元素Q、R、W、Y与元素X相邻。Y 的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧 化物的晶体类型是________;
(2)Q的具有相同化合价且可以相互转变的氧化物是__________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 __________________;
(4)这5种元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序 是(填化学式)________________________,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
②电子总数相同的氢化物的化学式和立体结构分别是
________________________________________________________________________;
(5)W和Q所形成的结构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加 热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和 该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是 ________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
解析 (1)由W与Q可形成一种高温结构陶瓷材料且W的氯化物分子为正四面体结构知 W为Si,其氧化物SiO2为原子晶体。
(2)与Si可形成高温结构陶瓷且相同化合价的氧化物可相互转变的元素Q为N,其氧化 物是NO2和N2O4。
(3)由Y的最高价氧化物的水化物是强酸及5种元素在周期表中的位置关系知Y为S元 素,X为P,R为As,R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学 式为As2S5。
(4)①5种元素分别形成的氢化物为:AsH3、PH3、NH3、SiH4、H2S,立体结构相同的氢 化物为NH3、PH3、AsH3,由于NH3分子间存在氢键,故NH3沸点最高,对于组成和结 构相似的一类物质,相对分子质量越大,沸点越高,故AsH3的沸点高于PH3。
②电子总数相同的氢化物是SiH4、PH3、H2S,其立体结构分别是正四面体、三角锥、V 形。
(5)由上述已知W为Si、Q为N,故SiCl4与NH3的反应方程式为:SiCl4+4NH3△,Si(NH2)4 +4HCl,Si(NH2)4分解生成Si3N4的化学方程式为:3Si(NH2)4高温,Si3N4+8NH3↑。
答案 (1)原子晶体 (2)NO2和N2O4 (3)As2S5
(4)①NH3、AsH3、PH3 NH3分子间存在氢键,故沸点最高,相对分子质量AsH3大于 PH3,所以分子间作用力AsH3大于PH3,故AsH3沸点高于PH3
②SiH4正四面体,PH3三角锥,H2S角形(V形)
(5)SiCl4+4NH3△,Si(NH2)4+4HCl、
3Si(NH2)4高温,Si3N4+8NH3↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com