
22.4/x = 43/8.6 X = 4.48L
22.4L 43克
X 74.6-66 = 8.6克
8.选D 解析:标况下 22.4LCl2与22.4LN2质量差为71-28 = 43克 则有
Cl2 N2 △m
7.选C 解析:据题给条件,可判断白色固体是CaCO3和NaOH。发生的反应可表示为:
NaHCO3 + CaO = CaCO3 ↓+ NaOH ………①
NaHCO3 + CaO + H2O = CaCO3 ↓+2 NaOH ………②
由于反应①在反应前后固体质量无变化,故固体增重是由反应②引起的。
NaHCO3 + CaO + H2O = CaCO3 ↓+2 NaOH 固体质量差
106 18
X ( 45-41.4 )
106∶X = 18∶( 45-41.4 ) 得 X=21.2克
6.选A解析: N2 + 3H2 = 2NH3 体积减小
1 3 2 2
由已知可知: ∶
∶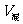 = 1∶4 而△
= 1∶4 而△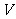 =
=
∴
5.选D 解析:本题涉及三种价态的四种金属,其共同特点都是失去电子发生氧化反应,若抓住物质在氧化还原反应中,每转移1mol电子所对应的质量--摩尔电子质量进行计算,则化繁为简。
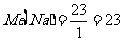
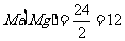
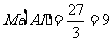

而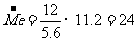
据平均值原理可知,原混合物一定含有Fe
4.选D 解析:由于每种氧化物Fe元素所呈化合价不一样,故可设其分子式为FeOx,而FeOx与HCl反应未发生氧化还原反应,生成物为FeCl2x,Fe2+变成Fe3+发生在与Cl2的反应之中,
则易知Fe元素的物质的量为:
Fe - 2XCl-
1mol 2X
n(Fe) 5 ×0.14
×0.14
n(Fe)
= 0.7/2x再利用得失电子守恒有:
解得X = 7/5
3.选D 解析:这是一道关于平衡的计算题,若能变换思维角度,则此题无需计算用化学原理直接推,即可得出结果。
据“等容等温时,等质量的任何气体,它们的压强与其物质的量成正比”及题给条件就不难判定出,混合气体总物质的量增加了。只有满足气体生成物的系数大于反应物的系数,才可能使气体物质的量增大。
则 4 + 3 < 2 + n 即 n > 5
24、为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
|
次数 |
混合物的质量/g |
所加Ba(OH)2溶液的体积/L |
测得沉淀的质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g
(2)混合物中K2CO3和NaHCO3的物质的量之比为 ;
(3)在25℃时,取下第3组实验所得溶液体积的十分之一,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。

23、化合物A含硫(每个分子只含一个硫原子)、氧以及一种或几种卤素。少量A与水反应完全水解但不发生氧化或还原,所有反应产物均可溶于水。将A配成水溶液稀释后分成几份,分别加入一系列0.1mol/L的试剂,现象如下:
①加入硝酸酸化的硝酸银,产生白色沉淀;
②加入氯化钡溶液,无沉淀产生;
③溶液经酸化后加入高锰酸钾溶液,紫色褪去,再加入硝酸钡溶液,产生白色沉淀。
(1)由此判断组成该化合物的元素中,可能存在的卤素有 ,A与水反应后生成的溶液中含有的离子可能有 。
(2)要确定该化合物的分子式,称取11.90gA溶于水稀释至250.00mL,取25.00mL溶液加入足量的高锰酸钾和硝酸钡溶液,使沉淀完全,沉淀经洗涤、干燥后称重为2.33g。试确定A的化学式,写出计算推理过程。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com