
22.答案 :
:
(1)上表中第(1)组数据加入的50mL盐酸的反应后有剩余,
理由是:第一组生成的气体最少,而2、3组生成的气体一样多,假如1组中盐酸不足,
 (3)设第4次实验中CO32-、HCO3-恰好生成沉淀,且沉淀质量为x′g,则有
(3)设第4次实验中CO32-、HCO3-恰好生成沉淀,且沉淀质量为x′g,则有
BaCO3 ~ CO32-
197 1mol
x′ (0.002+0.005)×4 x′=5.516g
或:由于第一次与第四次样品的质量比为:3.432: 0.858= 4: 1 而第一次与第四次沉淀的质量比为5.516: 1.379= 4:1 故第4次实验恰好沉淀,则原0.5L Ba(OH)2溶液中:
2OH- ~ Ba(OH)2 ~ BaCO3

21. 150ml
解析:当铝铁元素完全沉淀下来,此时溶液中只有NaNO3一种溶质,利用NO3-与Na+两种微粒守恒,则有:
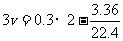
解得 V = 0.15升,即150ml
0.05C 0.3mol
易解得 C = 4mol/L
18.选C 解析:气体平均分子量 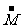 =m总/n总,
而此题中n总=1mol只要能计算出m总即可求解。据题意有:最后放出气体为O2,则其中NH3,NO2和部分O2都被稀H2SO4吸
=m总/n总,
而此题中n总=1mol只要能计算出m总即可求解。据题意有:最后放出气体为O2,则其中NH3,NO2和部分O2都被稀H2SO4吸 2FeCl3 - 3FeCl2 (Cl-守恒)
2FeCl3 - 3FeCl2 (Cl-守恒)
2mol 3mol
17.选C 解析:反应后溶液为Cu(NO3)2和HNO3,利用电荷守恒可求之。
C(H+) + 2C(Cu2+) = C (NO3-)
即: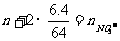
所以 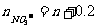
16.选 B 解析:此反应为可逆反应,X的转化率并未告诉,所以它的转率必在0~100%之间,当转化率为0时,M = 4.25×2 = 8.5,当X全部转化时,设反应前X为2mol ,则据反应方程式有,Y最多为1mol,Z为3mol ,则混合气体总的物质的量最多为4mol,而总质量不改变。

 [
[
而此反应已发生,但不可能完全转化。
所以:8.5 < M < 17 选 B
13.选C. 因为在[RO(OH)2]-中,R的化合价为+3价,它被亚硫酸钠还原的同时,亚硫酸钠 若 12克全为RO则 RO
- R(OH)2 △m
若 12克全为RO则 RO
- R(OH)2 △m
M+16 M+34 18 可得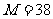
12 16-14
而此题12克为R 的单质和氧化物组成的混合物。
的单质和氧化物组成的混合物。
∴ 38 < M < 102
12.D 解析: 因为题目中无指明铁粉的量,所以铁粉可能是过量,也可能是不足,则与硫粉反应后,加入过量盐酸时生成的气体就有多种可能:或者只有H2S(铁全部转变为FeS2),或者是既有H2S又有H2(铁除了生成FeS2外还有剩余),所以只凭硫粉质量和生成的水的质量,不易建立方程求解.根据各步反应的定量关系,列出关系式:(1)Fe--FeS(铁守恒)--H2S(硫守恒)--H2O(氢守恒),(2)Fe--H2(化学方程式)--H2O(氢定恒),从而得知,无论铁参与了哪一个反应,每 1个铁都最终生成了1个H2O,所以迅速得出铁的物质的量就是水的物质的量,根本与硫无关,所以应有铁为9/18=0.5摩,即28克.
1个铁都最终生成了1个H2O,所以迅速得出铁的物质的量就是水的物质的量,根本与硫无关,所以应有铁为9/18=0.5摩,即28克.
10.选D。 解析:本题因涉及以两极产物的量,整个过程得失电子相等,所以首先应 的摩尔数,所以每消耗一摩HNO3都产生22.4L气体(可以是NO或NO2甚至是两者的混合物),现有气体2.24L,即有0.1摩HNO3参与了氧化还原反应,故所耗硝酸为0.16+0.1=0.26摩,其浓度为(0.26/0.03)mol/L,在8-9之间,只能选A.
的摩尔数,所以每消耗一摩HNO3都产生22.4L气体(可以是NO或NO2甚至是两者的混合物),现有气体2.24L,即有0.1摩HNO3参与了氧化还原反应,故所耗硝酸为0.16+0.1=0.26摩,其浓度为(0.26/0.03)mol/L,在8-9之间,只能选A.
9.选C 解析:因溶于水得色溶液,所以肯定无Na2CO3和FeCl3,杂质只能是MgCl2和NaCl中的一种或两种。假设11.1克全为CaCl2,则应生成沉淀28.7克, 11.1克全为MgCl2,则应生成沉淀33.5克,11.1克全为NaCl,则应生成沉淀27.2克。
而已知生成沉淀为29.7克,则必有MgCl2,可能有NaCl。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com