
16.(12分)(创新探究)已知气体X2和气体Y2在一定条件下能化合生成气体C,并知C的化学式只有三种可能:分别为XY、X2Y或X3Y。请设计实验(实验装置任选)来确定C的化学式,简述实验过程,分析说明结论。
实验过程:____
____________________________________________________________________
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
结论及分析:
①若实验结果是____________,则生成物C的化学式为XY。判断的依据是____
____________________________________________________________________
________________________________________________________________________。
②若实验结果是__________,则生成物C的化学式为X2Y。判断的依据是____
____________________________________________________________________
________________________________________________________________________。
解析 该题为通过实验确定生成物化学式。因为组成元素未知,所以不能定性分析,而需转化成可测控的量进行定量分析。根据反应物和生成物均为气体的特点,运用阿伏加德罗定律,可通过反应过程中体积变化或压强的变化值来确定反应物的物质的量之比,再由原子守恒得出生成物的化学式。
答案 方法一 实验及操作:(测定反应前后的数据、容器性能、恢复温度三项全对才可)
分别取同温、同压、等体积(V1)的X2和Y2两种气体充入一恒压、容积可变的密闭容器中,在一定条件下反应完全并恢复到原来温度后,测定容器的体积(V2)
结论及分析:
①V2=2V1 X2+Y2===2XY,反应前后分子数之比是1∶1,根据阿伏加德罗定律可推得以上结论
②V2=V1 2X2+Y2===2X2Y,反应前后分子数之比是4∶3,根据阿伏加德罗定律可推得以上结论
方法二 实验及操作:
分别取同温、同压、等体积的X2和Y2两种气体充入一恒容的密闭容器中,并测定容器的压强(p1),在一定条件下反应完全并恢复到原温度后,再测定容器的压强(p2)
结论及分析:
①p2=p1 X2+Y2===2XY,反应前后分子数之比是1∶1,根据阿伏加德罗定律可推得以上结论
②p2=p1 2X2+Y2===2X2Y,反应前后分子数之比是4∶3,根据阿伏加德罗定律可
推得以上结论
48.421 2 g-48.408 2 g=[29-Mr(A)]g/mol×
解得:Mr(A)=28
则Mr(B)=Mr(C)=Mr(A)=28
同理可求得Mr(D)=26,Mr(E)=30,Mr(F)=64
相对分子质量为28的气体可能有C2H4、CO、N2等。相对分子质量为26的气体为C2H2,相对分子质量为64的气体为SO2。
答案 (1)SO2 (2)30
(3)CaC2+2H2O―→Ca(OH)2+C2H2↑
(4)C2H4、CO、N2
15.(12分)(2009·苏北五校联考)某校化学小组学生进行“气体相对分子质量的测定”的实验。操作如下:用质量和容积都相等的烧瓶收集气体,称量收集满气体的烧瓶质量。数据见表(已换算成标准状况下的数值)。
|
气体 |
A |
B |
C |
D |
E |
F |
|
烧瓶和 |
|
|
|
|
|
|
|
气体的 |
|
|
|
|
|
|
|
总质量(g) |
48.408
2 |
48.408
2 |
48.408
2 |
48.382
2 |
48.434
2 |
48.876
2 |
已知标准状况下,烧瓶的容积为0.293 L,烧瓶和空气的总质量是48.421 2 g。空气的平均相对分子质量为29。A、B、C、D、E、F是中学常见的气体。
(1)上述六种气体中,能够使品红溶液褪色的是(写化学式)____________。
(2)E的相对分子质量是______________。
(3)实验室制取少量D的化学方程式是___
_____________________________________________________________________
________________________________________________________________________。
(4)A、B、C可能的化学式是______________。
解析 根据阿伏加德罗定律:
14.(8分)(2010·广东深圳检测)将4 mol O2和3 mol NxHy(y>x)的混合气体在150℃和1.05×105 Pa下点燃,完全反应后,恢复到原来的温度与压强时,测得反应后N2、O2、H2O(g)的混合气体比原混合气体的密度减少3/10。
(1)此反应的化学方程式是(用NxHy表示)
________________________________________________________________________
________________________________________________________________________。
(2)推算NxHy化学式的根据是____
____________________________________________________________________
________________________________________________________________________。
(3)x与y的关系式为____
____________________________________________________________________。
答案 (1)4NxHy+yO2===2xN2+2yH2O(g)
(2)质量守恒定律和阿伏加德罗定律
(3)2x+y=8
13.(8分)(2010·沈阳调研)(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为________。若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为________。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为________,混合气体的平均相对分子质量为________。
解析 (1)三种气体的平均相对分子质量为14.5×2=29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2的物质的量分数为(1-x),因此有:32x+28(1-x)=29,解得x=0.25。O2的质量分数为×100%=27.6%。
若CO和N2的物质的量之比为1∶1,设混合气体为1 mol,则混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为×100%=48.3%。
(2)设Cl2的体积为x mL,则O2的体积为(100-x) mL。
根据反应H2+Cl22HCl、2H2+O22H2O知,反应中消耗的H2为:x mL+2(100-x) mL=150 mL,解得x=50 mL。因此n(Cl2)∶n(O2)=1∶1。体积百分含量各占50%。混合气体的相对分子质量为:71×50%+32×50%=51.5。
答案 (1)27.6% 48.3% (2)1∶1 51.5
12.(2010·天津二模)下列说法正确的是 ( )
①标准状况下,22.4 L己烯含有的分子数为6.02×1023
②标准状况下,a L的氧气和氮气的混合物含有的分子数约为×6.02×1023
③7.1 g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2×6.02×1023
④1 mol乙醇中含有的共价键数约为7×6.02×1023
定时检测·271-272· 第一章 化学计量在实验中的应用⑤500 mL 1 mol/L的硫酸加NaOH溶液溶液中含有的硫酸根离子数约为1.5×6.02×1023
A.①④ B.②⑤ C.③④ D.②④
解析 ①标准状况下己烯为液体;③7.1 g Cl2为0.1 mol,与NaOH反应时只有全部变为Cl-时,转移电子数才为0.2×6.02×1023,而Cl2与NaOH反应时不可能全部变为Cl-;
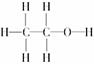
④乙醇的结构式为 , 应含有8×6.02×1023个共价键;②⑤正确。
答案 B
11.(2009·苏州模拟)现有A、B、C三种化合物,各取40 g相混合,完全反应后,得18 g B、49 g C,还有D生成。已知D的相对分子质量为106。现将22 g A和11 g B反应,能生成D ( )
A.1 mol B.0.5 mol C.0.275 mol D.0.25 mol
答案 D
10.(2010·潍坊质检)标准状况下,a L气体X2和b L气体Y2恰好完全反应生成c L气体Z,若2a=6b=3c,则Z的化学式为 ( )
A.XY2 B.X2Y C.X3Y D.XY3
解析 由=知3X2+Y2===2XmYn,∴m=3,n=1。
答案 C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com