
4.考试结束后,将答题卡交回。
第Ⅰ卷
说明:本卷共35小题,每小题4分,共140分。在每题给出的四个选项中,只有一项是符合题目要求的。
26.答案(5分)
(1)第四周期第ⅡA族,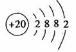
(2) 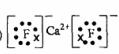 ,高
,高
(3)2P+5FeO+3CaO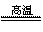 Ca3(PO4)2+5Fe
Ca3(PO4)2+5Fe
(4)Fe;Fe+3SCN-=Fe(SCN)3
(5)1.1
[解析]本题考查钙、铁的知识。(1)Ca为20号,位于第四周期,第IIA族。(2)最活泼的金属为:F,  为离子化合物,
为离子化合物,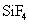 为分子晶体,故
为分子晶体,故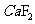 的沸点高。(3)P从0价升至+5价,
的沸点高。(3)P从0价升至+5价,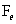 从+2价降至0价,根据得失电子守恒有,P前配2,
从+2价降至0价,根据得失电子守恒有,P前配2,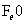 前配5.(4)有颜色变化可知,红褐色
前配5.(4)有颜色变化可知,红褐色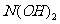 为
为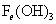 ,
,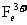 与KSCN变血红色。(5)
与KSCN变血红色。(5)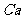 与
与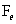 中只有
中只有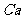 与水能反应生成
与水能反应生成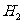 ,由
,由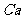 ~
~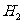 得,n(
得,n(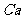 )=0.224/22.4=0.01mol。n(
)=0.224/22.4=0.01mol。n(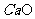 )=1.6×3.5%/56=0.01MOL。由钙守恒得,m(
)=1.6×3.5%/56=0.01MOL。由钙守恒得,m(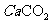 )=(0.01+0.001)×100=1.1g。
)=(0.01+0.001)×100=1.1g。
26.(2010重庆卷)(15分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和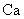 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)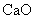 .
.
(1)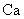 元素在周期表中位置是
,其原子结构示意图
.
元素在周期表中位置是
,其原子结构示意图
.
(2)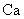 与最活跃的非金属元素A形成化合物D,D的电子式为
,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为
,D的沸点比A与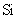 形成的化合物E的沸点
.
形成的化合物E的沸点
.
(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO
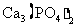 + Fe
+ Fe
(4)将钙线试样溶于稀盐酸后,加入过量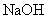 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色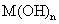 .则金属M为______;检测
.则金属M为______;检测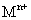 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml.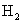 (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的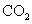 ,最多能得到
,最多能得到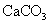 g.
g.
26. 答案:(1)三 ⅥA
(2)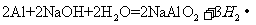
(3)硫酸钠(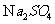 )
2
)
2
(4)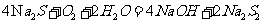
(或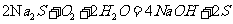
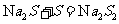 )
)
(5)溶液由黄色变为无色,产生浅黄色沉淀和(臭鸡蛋气味的)气体
解析:本题考查的知识点有元素及其化合物的性质、物质结构、氧化还原反应相关计算。
由生成白色沉淀D ,D既能溶于强酸,也能溶于强碱,推测D是Al(OH)3
再逆推可知,B为Al 。G在大气中能导致酸雨的形成,可猜测G可能为SO2
逆推可知: A为S,综合可知C为Al2S3 D为Al(OH)3,E为H2S,G为SO2
F为Na2S.
(1)(2)比较简单,(3)SO2与氯酸钠在酸性条件下反应,SO2为还原剂
被氧化为SO42-,根据电子得失可以判断生成2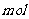 二氧化氯时,转移电子2
二氧化氯时,转移电子2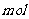 。
。
由H与过氧化钠的结构和化学性质相似,其溶液显黄色。
结合前面的信息可以推测H为Na2S2.
26.(2010四川理综卷)(15分)
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族
(2)B与氢氧化钠溶液反应的化学方程式为:
。
(3)
G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为
,当生成2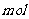 二氧化氯时,转移电子
二氧化氯时,转移电子
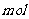 。
。
(4) 溶液F在空气中长期放置生成H的化学反应方程式为:
。
(5) H的溶液与稀硫酸反应产生的现象为
。
21.(2010江苏卷)(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用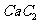 与水反应生成乙炔。
与水反应生成乙炔。
(1) 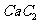 中
中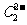 与
与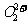 互为等电子体,
互为等电子体,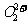 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol
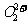 中含有的
中含有的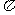 键数目为
。
键数目为
。
(2)将乙炔通入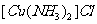 溶液生成
溶液生成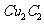 红棕色沉淀。
红棕色沉淀。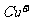 基态核外电子排布式为
。
基态核外电子排布式为
。
 (3)乙炔与氢氰酸反应可得丙烯腈
(3)乙炔与氢氰酸反应可得丙烯腈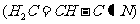 。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
。丙烯腈分子中碳原子轨道杂化类型是
;分子中处于同一直线上的原子数目最多为
。
(4) 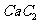 晶体的晶胞结构与
晶体的晶胞结构与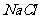 晶体的相似(如右图所示),但
晶体的相似(如右图所示),但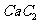 晶体中含有的中哑铃形
晶体中含有的中哑铃形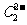 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。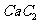 晶体中1个
晶体中1个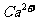 周围距离最近的
周围距离最近的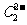 数目为
。
数目为
。
[答案]
(1) 2NA
2NA
(2)1s22s22p63s23p63d10
(3)sp杂化 sp2杂化 3
(4)4
[解析]本题主要考察核外电子排布式、等电子体原理、杂化轨道、分子的平面构型、晶体结构等
(1)根据等电子体原理可知,O22+的电子式 ,在1mol三键含有2mol的
,在1mol三键含有2mol的 键和1mol的
键和1mol的 键,故1mol O22+中,含有2NA个
键,故1mol O22+中,含有2NA个 键
键
(2)Cu为29号元素,要注意3d轨道写在4s轨道的前面同时还有就是它的3d结构,Cu+的基本电子排布式为1s22s22p63s23p63d10
(3)-通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化,同一直线上有3个原子。
(4)依据晶胞示意图可以看出,从晶胞结构图中可以看出,1个Ca2+周围距离最近的C22-
有4个,而不是6个,要特别主要题给的信息。
23.(2010上海卷)胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(Mg2Si3O8.nH2O)等化合物。
1)三硅酸镁的氧化物形式为 ,某元素与镁元素不同周期但在相邻一族,且性质和镁元素十分相似,该元素原子核外电子排布式为 。
2)铝元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子。
3)某元素与铝元素同周期且原子半径比镁原子半径大,该元素离子半径比铝离子半径 (填“大”或“小”),该元素与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:
4) Al2O3、MgO和SiO2都可以制耐火材料,其原因是 。
a.Al2O3、MgO和SiO2都不溶于水
b.Al2O3、MgO和SiO2都是白色固体
c.Al2O3、MgO和SiO2都是氧化物
d.Al2O3、MgO和SiO2都有很高的熔点
答案:1)2MgO.3SiO.nH2O、1s22s1;2)13、5;3)大、Al(OH)3+OH-→AlO2-+2H2O;4)ad。
解析:此题考查了硅化合物、元素周期表、原子的核外电子排布、原子的核外电子运动状态、元素周期律等知识。1)根据胃舒平中三硅酸镁的化学式和书写方法,其写作:2MgO.3SiO.nH2O;与镁元素在不同周期但相邻一族的元素,其符合对角线规则,故其是Li,其核外电子排布为:1s22s1;2)中铝元素原子的核外共有13个电子,其每一个电子的运动状态都不相同,故共有13种;有1s、2s、2p、3s、3p共5个能级;3)与铝元素同周期且原子半径大于镁的元素是钠,其离子半径大于铝的离子半径;两者氢氧化物反应的离子方程式为:Al(OH)3+OH-→AlO2-+2H2O;4)分析三种氧化物,可知三者都不溶于水且都具有很高的熔点。
技巧点拨:硅酸盐用氧化物的形式来表示组成的书写顺序是:活泼金属氧化物→较活泼金属氧化物→非金属氧化物→二氧化硅→水,并将氧化物的数目用阿拉伯数字在其前面表示。比如斜长石KAlSi3O8:K2O·Al2O3·6SiO2。
30.(2010福建卷)[化学-物质结构与性质] (13分)
(1)中国古代四大发明之一--黑火药,它的爆炸反应为
 (已配平)
(已配平)
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知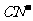 与
与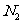 结构相似,推算HCN分子中
结构相似,推算HCN分子中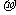 键与
键与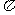 键数目之比为 。
键数目之比为 。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,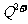 的未成对电子数是
。
的未成对电子数是
。
(3 )在
)在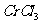 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为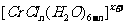 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
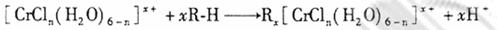
交换出来的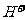 经中和滴定,即可求出x和n,确定配离子的组成。¥高#考#资%源*网
经中和滴定,即可求出x和n,确定配离子的组成。¥高#考#资%源*网
将含0.0015
mol 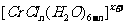 的溶液,与R-H完全交换后,中和生成的
的溶液,与R-H完全交换后,中和生成的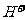 需浓度为0.1200 mol·L-1
NaOH溶液25.00 ml,该配离子的化学式为
。
需浓度为0.1200 mol·L-1
NaOH溶液25.00 ml,该配离子的化学式为
。
解析:(1)①钾为活泼金属,电负性比较小;在同周期 在同周期,非金属性逐渐增强,电负性也逐渐增大 ②
在同周期,非金属性逐渐增强,电负性也逐渐增大 ②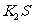 是离子化合物,属于离子晶体,产物中含有极性共价键的分子为
是离子化合物,属于离子晶体,产物中含有极性共价键的分子为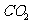 ,其空间构型为直线型,中新源自轨道杂化类型为sp;③
,其空间构型为直线型,中新源自轨道杂化类型为sp;③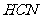 中
中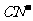 与
与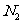 结构相同,含有三个键,一个σ键和两个
结构相同,含有三个键,一个σ键和两个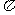 键;另外
键;另外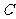 和
和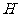 之间形成一个σ键,所以
之间形成一个σ键,所以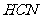 分子中σ键和
分子中σ键和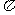 键数目之比为2:2,即为1:1.
键数目之比为2:2,即为1:1.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,应该都属于第Ⅷ族元素,原子序数T比Q多2,可以确定T为Ni,Q为Fe,所以T的基态原子外围电子(价电子)排布为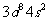 ,
,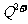 即Fe2+的未成对电子数是4.
即Fe2+的未成对电子数是4.
(3)中和生成的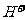 需要浓度为0.1200mol
需要浓度为0.1200mol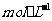
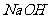 溶液25.00ml,则可以得出
溶液25.00ml,则可以得出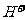 的物质的量为0.12×25.00×10-3=0.0030mol,所以x=0.0030/0.0015=2;
的物质的量为0.12×25.00×10-3=0.0030mol,所以x=0.0030/0.0015=2;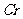 的化合价为+3价,x=2可以得知n=1,即该配离子的化学式为
的化合价为+3价,x=2可以得知n=1,即该配离子的化学式为 .
.
答案:(1)①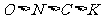 ②离子晶体
③1:1.
②离子晶体
③1:1.
(2)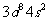
(3)
23.(2010福建卷)(15分)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215k J。
该反应的热化学方程式为________。
J。
该反应的热化学方程式为________。
解析:
(1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元素,则T为氯元素,处于第三周期第七主族
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为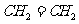
(3)M和T形成的化合物为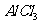 ,与水反应
,与水反应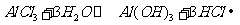 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应: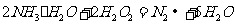
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应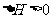 ,
,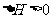 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入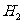 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式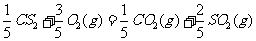
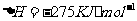
答案:(1)  ;
ⅦA
;
ⅦA
(2)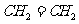
(3)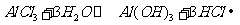 ,
,
(4)①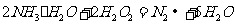
②a和c;a或c
(5)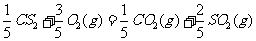
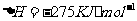
25.(2010安徽卷)(14分)
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+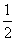 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0
kJ·mol-2
H=-283.0
kJ·mol-2
Y(g)+ O2(g)=YO2(g)  H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
答案:(1)3 VIA HClO4
(2)2 H-Z H-Y
(3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2
(4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol
解析:由表中可知,X为C Y为 S Z为 Cl W为Cu
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com