
2.化学已渗透到人类生活的各个方面。下列说法不正确的是
A.阿司匹林具有解热镇痛作用
B.可以用Si3N4、Al2O3制作高温结构陶瓷制品
C.在入海口的钢铁闸 门上装一定数量的铜块可防止闸门被腐蚀
门上装一定数量的铜块可防止闸门被腐蚀
D.禁止使用四乙基铅作汽油抗爆震剂,可减少 汽车尾气污染
汽车尾气污染
1、解析:所谓低碳经济,是指在可持续发展理念指导下,通过技术创新、制度创新、产业转型、新能源开发等多种手段,尽可能地减少煤炭石油等高碳能源消耗,减少温室气体排放,达到经济社会发展与生态环境保护双赢的一种经济发展形态。发展氢能和太阳能,限制塑料的使用,和发展绿色化学,都符合低碳经济。
答案:D
命题立意:考查低碳经济。本题关注社会,密切联系实际进行了命题。
1.以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。下列做法违背发展低碳经济的是
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂
29.(16分)四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
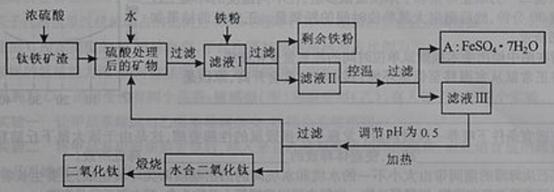
请回答下列问题:
(1) 硫酸与二氧化钛反应的化学方程式是____________________________________。
(2) 向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3) 在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kgA(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
答案:(1) 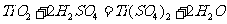 或
或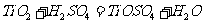
(2)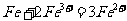
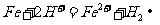
(3) 加水促进钛盐水解,加热促进钛盐水解,降低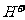 浓度促进钛盐水解
浓度促进钛盐水解
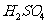
(4) 
解析:本题属于化工生产流程题。(1)考查酸的通性,可以与金属氧化物反应,又知道TI的化合价,可以写出化学方程式。(2)加入浓硫酸后,浓硫酸可以氧化亚铁离子,再加入铁粉,铁粉可以还原铁离子。除此外,铁粉还可以与溶液中的H+反应、(3)考查了影响盐类水解的因素。(4)考虑最后溶质是只有硫酸钠和硫酸铁,根据开始加入A为2a×103mol加入适量氢氧化钠溶液恰好完全反应.,说明加入氢氧化钠的物质的量为4a×103mol,后来又加入12b×103mol的A,和2c×103mol的铁。根据电荷守恒,溶质中硫酸钠消耗硫酸根离子为2a×103mol,。而溶液中加入的硫酸根离子物质的量共计为(2a+12b)×103mol,这样剩下的硫酸根就与铁离子结合。可知消耗铁离子为8b×103mol,根据铁元素守恒。nFe=(2a+4b+2c) ×103mol,n Fe2O3=(a+2b+c)
×103mol,计算得mFe2O3= kg.
kg.
28.(13)已知:
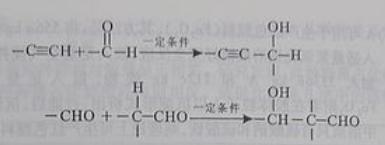
以乙炔为原料,通过下图所示步骤能合成有机中间体E(转化过程中的反应条件及部分产物已略去)。

其中,A,B,C,D分别代表一种有机物,B的化学式为C4H10O2,分子中无甲基。
请回答下列问题:
(1) A生成B的化学反应类型是____________________________。
(2) 写出生成A的化学反应方程式_________________________________________。
(3) B在浓硫酸催化下加热,可生成多种有机产物。写出2种相对分子质量比A小的有机产物的结构简式:_________________、__________________。
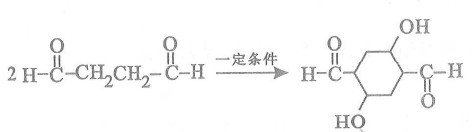
(4) 写出C生成D的化学反应方程式:
__________________________________________________________________。
(5)含有苯环,且与E互为同分异构体的酯有______种,写出其中一种同分异构体的结构简式:____________________________________________________________________。
答案:(1) 加成反应(还原反应)
(2)
(3)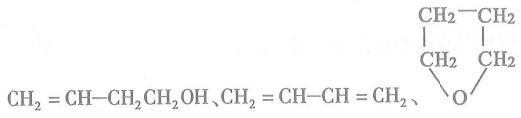
(4)
(5)6 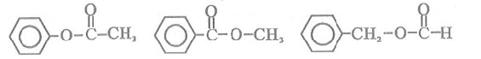
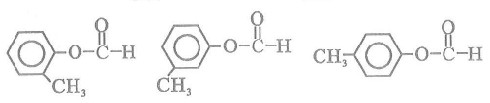
解析:本题考查学生接受信息的能力,根据题目提供的新信息结合已有的知识进行综合处理。
A到B结合B的分子式C4H10O2,可知由乙炔和甲醛反应有2mol甲醛参与反应。A到B是与氢气反应属于加成或者还原反应。根据B的分子式可知A与2mol氢气加成。B到C是进一步氧化为醛,两端的羟基全部被氧化为醛基。(3)问考查了醇的消去,有三种消去方式。任写两种即可。(4)要想作对这一问需要仔细观察题目给的信息第二个反应机理。(5)考查官能团位置异构,即酯基异构。
27.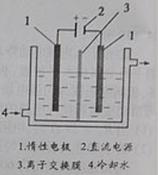 (16分)
(16分)
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶
于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质
碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用
方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
|
实验方法 |
实验现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
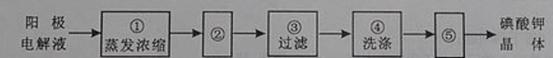
步骤②的操作名称是 ,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是
。
答案:(1)紫黑色 升华
(2)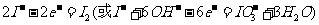
有气泡产生
(3)
|
实验方法 |
实验现象及结论 |
|
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝。 |
如果不变蓝,说明无 。(如果 。(如果变蓝,说明有 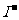 。) 。) |
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
解析:(1)考查物质的物理性质,较容易。(2)阳极发生氧化反应失电子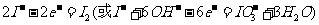 。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水。(3)考查I-的检验此题借助与碘单质遇淀粉变蓝色这一特性,要设法将碘离子转化为碘单质。(4)考查实验的基本操作。要求考生对整个流程分析透彻。
。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水。(3)考查I-的检验此题借助与碘单质遇淀粉变蓝色这一特性,要设法将碘离子转化为碘单质。(4)考查实验的基本操作。要求考生对整个流程分析透彻。
26. 答案:(1)三 ⅥA
(2)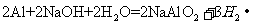
(3)硫酸钠(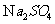 ) 2
) 2
(4)
(或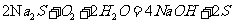
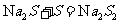 )
)
(5)溶液由黄色变为无色,产生浅黄色沉淀和(臭鸡蛋气味的)气体
解析:本题考查的知识点有元素及其化合物的性质、物质结构、氧化还原反应相关计算。
由生成白色沉淀D ,D既能溶于强酸,也能溶于强碱,推测D是Al(OH)3
再逆推可知,B为Al 。G在大气中能导致酸雨的形成,可猜测G可能为SO2
逆推可知: A为S,综合可知C为Al2S3 D为Al(OH)3,E为H2S,G为SO2
F为Na2S.
(1)(2)比较简单,(3)SO2与氯酸钠在酸性条件下反应,SO2为还原剂
被氧化为SO42-,根据电子得失可以判断生成2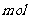 二氧化氯时,转移电子2
二氧化氯时,转移电子2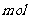 。
。
由H与过氧化钠的结构和化学性质相似,其溶液显黄色。
结合前面的信息可以推测H为Na2S2.
26.(15分)
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
请回答下列问题:
(1)组成单质A的元素位于周期表中第 周期,第 族。
(2)B与氢氧化钠溶液反应的化学方程式为:
。
(1)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为
,当生成2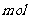 二氧化氯时,转移电子
二氧化氯时,转移电子
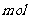 。
。
(2)溶液F在空气中长期放置生成H的化学反应方程式为:
。
(3)H的溶液与稀硫酸反应产生的现象为
。
13.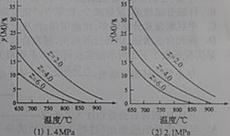 反应aM(g)+bN(g)
反应aM(g)+bN(g)  cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
cP(g)+dQ(g)达到平衡时。M的体积分数y(M)与反应条件的关系如图所示。其中:Z表示反应开始时N的物质的量与M的物质的量之比。下列说法正确的是
A.同温同压Z时,加入催化剂,平衡时Q的体积分数增加
B.同压同Z时,升高温度,平衡时Q的体积分数增加
C.同温同Z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加Z,平衡时Q的体积分数增加。
答案:B
解析:本题考查了平衡移动原理的应用。A项加入催化剂只能改变反应速率,不会使平衡移动。B项由图像(1)知随着温度的升高M的体积分数降低,说明正反应吸热,所以温度升高平衡正向移动,Q的体积分数增加。C项对比(1)(2)可以看出相同温度条件,压强增大M的体积分数增大,所以正反应是体积缩小的反应,增大压强Q的体积分数减小。D项由C项可以判断D也不对。
12.标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A.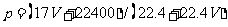 B.
B. 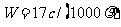
C. 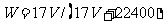 D.C=1000Vρ/(17V+22400)
D.C=1000Vρ/(17V+22400)
答案:A
解析:本题考查基本概念。考生只要对基本概念熟悉,严格按照基本概念来做,弄清质量分数与物质的量浓度及密度等之间的转化关系即可。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com