
4.下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
3. 下列离子方程式表达正确的是
下列离子方程式表达正确的是
A.用惰性电极电解熔融氯化钠: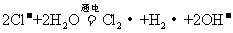
B.用氢氧化钠溶液除去铝表面的氧化膜: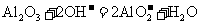
C.用稀氢氧化钠溶液吸收二氧化氮: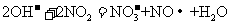
D.用食醋除去水瓶中的水垢: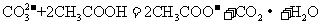
[答案]B
[解析]本题主要考查的是离子方程式的正误判断。A项,电解的是熔融状态的NaCl,不是NaCl溶液,2NaCl 2Na + Cl2↑;B项,Al2O3能溶于NaOH溶液,生成偏铝酸盐;C项,NO2与NaOH反应,生成硝酸盐和亚硝酸盐,2OH- + 2NO2 = NO3-
+ NO2- + H2O;D项,水垢中的主要成分为CaCO3,是难溶物。综上分析可知,本题选B项。
2Na + Cl2↑;B项,Al2O3能溶于NaOH溶液,生成偏铝酸盐;C项,NO2与NaOH反应,生成硝酸盐和亚硝酸盐,2OH- + 2NO2 = NO3-
+ NO2- + H2O;D项,水垢中的主要成分为CaCO3,是难溶物。综上分析可知,本题选B项。
2. 水是最宝贵的资源之一。下列表述正确的是
水是最宝贵的资源之一。下列表述正确的是
A.H2O的电子式为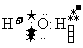
B.4℃时,纯水的pH=7
C.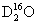 中,质量数之和是质子数之和的两倍
中,质量数之和是质子数之和的两倍
D.273K、101kPa,水分子间的平均距离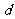 :
: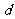 (气态)>
(气态)>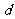 (液态)>
(液态)>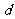 (固态)
(固态)
1.化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.为提高农作物的产量和质量,应大量使用化肥和农药
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D.垃圾是放错地方的资源,应分类回收利用
33.(16分)
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl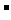 、OH
、OH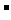 和SO
和SO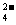 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO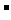 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL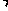 L-1H2SO4、1moL
L-1H2SO4、1moL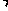 L-1NaOH、0.01mol
L-1NaOH、0.01mol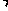 L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL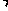 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
 |
|
步骤2: |
|
|
步骤3: |
|
⑴SO2+2NaOH
=Na2SO3+H2O ⑵Na2SO3 ⑶只存在ClO- 。步骤2:在A试管中滴加0.01mol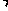 L-1KMnO4溶液1~2滴,振荡 预期现象和结论:如果溶液颜色褪去,说明有SO32-,则假设1成立,反之则说明没有SO32-,则假设1不成立。
L-1KMnO4溶液1~2滴,振荡 预期现象和结论:如果溶液颜色褪去,说明有SO32-,则假设1成立,反之则说明没有SO32-,则假设1不成立。
步骤3:在B试管中滴加淀粉-KI溶液1~2滴,振荡 预期现象和结论:如果溶液颜色变蓝色,说明有ClO-,则假设3成立。反之则说明没有ClO-,则假设3不成立
以上分析如有不足的地方,欢迎大家批评指正!!
1.根据原子守恒可知为:6H2↑ 2. ①温度越高反应速度越快,升温平衡向正方向移动;温度越低反应速度越慢,降温平衡向逆方向移动。②反应为吸热:> 3.根据平衡常数的公式可知:K=5.7×10-10 mol·L-1(可以不写单位)
32(16分)
碳酸锂广泛应用于陶瓷和医药等领域。已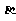 -锂辉石(主要成分为Li2O
-锂辉石(主要成分为Li2O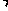 Al2O3
Al2O3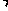 4SiO2)为原材料制备Li2CO3的工艺流程如下:
4SiO2)为原材料制备Li2CO3的工艺流程如下:
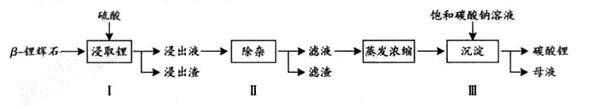
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ前,B-锂辉石要粉碎成细颗粒的目的是_____________.
(2)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+、Na+等杂质,需在搅拌下加入_____________(填“石灰石”、“氯化钙”或“稀硫酸”)以调节溶液的PH到6.0~6.5,沉淀部分杂质离子,然后分离得到浸出液。
(3)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去的杂质金属离子有______________.
(4)步骤Ⅲ中,生成沉淀的离子方程式为________________.
(5)从母液中可回收的主要物质是_____________.
⑴增加接触面积使反应充分同时加快反应速度。⑵石灰石。石灰石与酸作用,才可调节溶液的PH值。调节溶液的PH到6.0~6.5,沉淀部分杂质离子,此时Al3+、Fe3+已除去。⑶Fe2+ ,Mg2+、Ca2+ 。加入适量的H2O2溶液、石灰乳为了把Fe2+ ,Mg2+除去,加入适量Na2CO3溶液为了除去Ca2+ ,过滤后,滤液为LiOH和Li2SO4。蒸发浓缩滤液和加入饱和碳酸钠溶液有利于得到Li2CO3沉淀。
⑷2Li++CO32-=Li2CO3↓ ⑸NaOH、Na2SO4
31.(16分)
硼酸(H3BO3)在食品、医药领域应用广泛.
(1) 请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________.
(2) 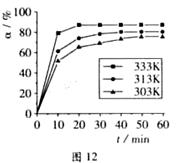 在其他条件相同时,反应H3BO3 +3CH3OH
在其他条件相同时,反应H3BO3 +3CH3OH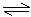 B(OCH3)3
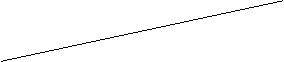
+3H2O中,H3BO
3的转化率(α)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
B(OCH3)3
+3H2O中,H3BO
3的转化率(α)在不同温度下随反应时间(t)的变化见图12,由此图可得出:
① 温度对应该反应的反应速率和平衡移动的影响是_______.
② 该反应的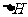 _____0(填“<”、“=”或“>”).
_____0(填“<”、“=”或“>”).
(3) H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l)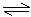 [B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈
c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字).
[B(OH)4]-(
aq)+H+(aq)已知0.70 mol·L-1 H3BO
3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)≈
c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字).
3.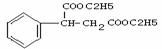 4.
4.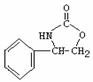 或
或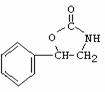 。利用逆向思维,反应②产物有两种断键方式:
。利用逆向思维,反应②产物有两种断键方式: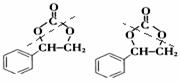 则可以得到
则可以得到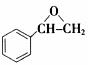 和CO2。故答案为以上两种。5.AB。化合物Ⅵ和Ⅶ,分子式均为C9H8O,且都能发生银镜反应,反应时苯环不参与反应。结合不饱和度可知:化合物Ⅵ和Ⅶ含有苯环,醛基,碳碳双键。
和CO2。故答案为以上两种。5.AB。化合物Ⅵ和Ⅶ,分子式均为C9H8O,且都能发生银镜反应,反应时苯环不参与反应。结合不饱和度可知:化合物Ⅵ和Ⅶ含有苯环,醛基,碳碳双键。
2.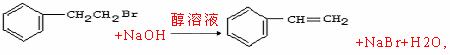
1.C8H8,10mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com