
(10年上海卷地理)
(10年重庆卷文综第11题)
地理学中常用方格网法来研究各种问题。如图5中将某个
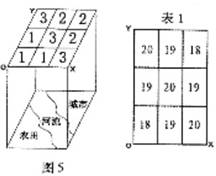 区域划分为九个方格,数字“1”、“2”、“3”分别表示农业用
区域划分为九个方格,数字“1”、“2”、“3”分别表示农业用
地、建设用地、水域,则可能通过这些数据来分析该区域的土
地利用状况。根据图5、表1,回答11题。
11. 若通过这种方法获得的该区域海拔(米)如表1所示,则此
地最可能位于
A.四川盆地 B. 长江下游
C.东北平原 D. 黄河下游
[答案]11.D
解析:根据表1数据可以看出该区河流的海拔高于两岸,为地上“悬河”,因此可以判断此地位于黄河下游。
含量、气温的年变化。据此完成14-15题。
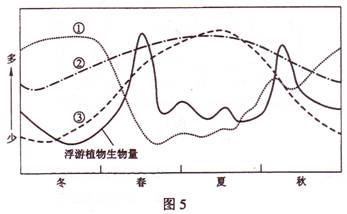
14.表示光照、营养物质含量、气温年变化的曲线依次是
A.①②③ B.②①③
C.③②① D.③①②
[答案]B
15.若营养物质供应充足,则该湖泊浮游植物大量繁殖大约会持续
A.1个月 B.3个月
C.6个月 D.12个月
[答案]C
(10年北京卷文综第9题)
图4是非洲乍得湖流域图。读图
,回答第8、9题。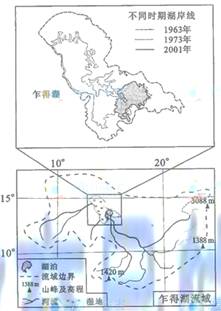
9.根据图中信息可以判断
A.流域面积缩小
B.湖泊水位总体下降
C.流域主体位于热带荒漠
D.1963年时湖底东南高,西北低
[答案]B
[命题立意]本题主要考查读图判读能力。难度容易。
[解题思路]由题图,尤其是图4中的上图,很容易根据图中标注的不同时期的湖岸线的变化及湖泊所在流域情况,该湖泊所在流域几乎没有变化,而变化的只是湖泊实际蓄水水域范围,显然选项A错误。而据图示的不同时期湖岸线的变化情况,很容易判断选项B正确。从图示经纬度判断,该地位于非洲热带草原气候区,选项C错误。从题图看出,从1963-2001年间,水体最深地区都是在湖泊的东南,所以判断出该湖底是西北高东南低,选项D错误。
(10年海南卷地理)
图5中4条曲线分别示意北半球中纬度某湖泊的浮游植物生物量与光照、营养物质
33.(2010广东理综卷)(16分)
某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH = ________________.
(2)反应Cl2+Na2SO3+2 NaOH===2NaCl+Na2SO4+H2O中的还原剂为________________.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、OH
、OH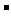 和SO
和SO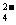 .请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
① 提出合理假设 .
假设1:只存在SO32-;假设2:既不存在SO32-也不存在ClO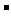 ;假设3:_____________.
;假设3:_____________.
② 设计实验方案,进行实验。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:3moL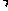 L-1H2SO4、1moL
L-1H2SO4、1moL L-1NaOH、0.01mol
L-1NaOH、0.01mol L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
|
实验步骤 |
预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 moL L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. L-1
H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中. |
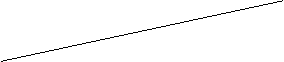 |
|
步骤2: |
|
|
步骤3: |
|
解析:(1) NaOH过量,故生成的是正盐:SO2+2NaOH =Na2SO3+H2O。
(2)S元素的价态从+4→+6,失去电子做表现还原性,故还原剂为Na2SO3。
(3)①很明显,假设3两种离子都存在。
②加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;在A试管中滴加紫色石蕊试液,若先变红后退色,证明有ClO-,否则无;在B试管中滴加0.01mol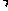 L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
L-1KMnO4溶液,若紫红色退去,证明有SO32-,否则无。
8.(2010江苏卷)下列说法不正确的是
A.铅蓄电池在放电过程中,负极质量减小,正极质量增加
B.常温下,反应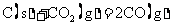 不能自发进行,则该反应的
不能自发进行,则该反应的
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.相同条件下,溶液中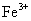 、
、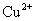 、
、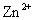 的氧化性依次减弱
的氧化性依次减弱
[答案]AC
[解析]本题主要考查的是相关的反应原理。A项,铅蓄电池在放电过程中,负极反应为 其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,
其质量在增加;B项,该反应是典型的吸热反应,在常温下不能自发进行;C项,催化剂能改变反应速率,不一定加快,同时它不能改变转化率;D项,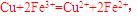 可知
可知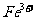 的氧化性大于
的氧化性大于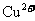 ,综上分析可知,本题选AC项。
,综上分析可知,本题选AC项。
7.(2010安徽卷) 亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
A. Li2NH中N的化合价是-1 B.该反应中H2既是氧化剂又是还原剂
C.Li+和H+的离子半径相等 D.此法储氢和钢瓶储氢的原理相同
答案:B
解析:A选项中Li2NH中氮的化合价为-3;C选项中Li+半径小于H-;D选项钢瓶储氢是物理过程,而该方法为化学方法。
7.(2010广东理综卷)能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43-、Cl- B.Fe3+、H+、I-、HCO3-
C.K+、Na+、NO3- 、MnO4- D.Al3+、Mg2+ 、SO42- 、CO32-
解析:A中Ag+和PO43-、Cl-因生成沉淀不共存;B中H+和HCO3-离子生成气体不共存,Fe3+和I-因发生氧化还原反应不共存;D中Al3+和CO32-因互促水解不共存。
答案:C
5.(2010天津卷)下列实验设计及其对应的离子方程式均正确的是
A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+ = Cu2+ + 2Fe2+
B.Na2O2与H2O反应制备O2 :Na2O2 + H2O = 2Na+ + 2OH- + O2↑
C.将氯气溶于水制备次氯酸:Cl2 + H2O = 2H+ + Cl- + ClO-
D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO +
6H+ + 5H2O2 = 2Mn2+ + 5O2↑
+ 8H2O
+
6H+ + 5H2O2 = 2Mn2+ + 5O2↑
+ 8H2O
解析:B中元素不守恒,正确的离子方程式为:2Na2O2+2H2O==4Na++4OH-+O2;C中的HClO是弱酸,不能拆成离子形式;D的离子方程式本身没有问题,但KMnO4的强氧化性能将浓盐酸氧化,不能实现证明H2O2具有还原性的目的(还原性:HCl>H2O2,HCl先反应),D错。
答案:A
命题立意:考查离子方程式的正误判断。
10.对下列语句中加点词的解释,不正确的一项是
A.则相与笑之曰:鄙 鄙:卑鄙
B.场功甫毕 甫:刚刚
C.或采橡实、畜菜根以延冬春 畜:通“蓄”
D.籍之以为厢兵 籍:登记
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com