
6、常温下,下列各组离子在指定溶液中能大量共存的是
A.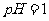 的溶液中:
的溶液中: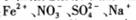
B.由水电离的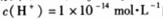 的溶液中:
的溶液中: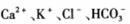
C.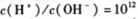 的溶液中:
的溶液中:
D.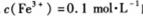 的溶液中:
的溶液中: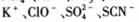
5.设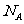 为阿伏伽德罗常数的值,下列叙述正确的是
为阿伏伽德罗常数的值,下列叙述正确的是
A.常温下,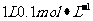 的
的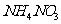 溶液中氮原子数为0.2
溶液中氮原子数为0.2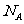
B.1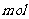 羟基中电子数为10
羟基中电子数为10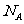
C.在反应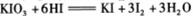 中,每生成3
中,每生成3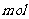
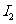 转移的电子数为6
转移的电子数为6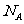
D.常温常压下,22.4L乙烯中 键数为4
键数为4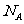
4.下列有关物质的性质或应用的说法不正确的是
A.二氧化硅是生产光纤制品的基本原料
B.水玻璃可用于生产黏合剂和防火剂
C.盐析可提纯蛋白质并保持其生理活性
D.石油分馏可获得乙烯、丙烯和丁二烯
3.下列离子方程式表达正确的是
A.用惰性电极电解熔融氯化钠: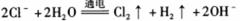
B.用氢氧化钠溶液出去铝表面的氧化膜:
C.用稀氢氧化钠吸收二氧化氮: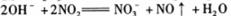
D.用食醋除去水瓶中的水垢: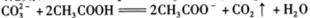
2、谁是最宝贵的资源之一。下列表述正确的是
A.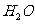 的电子式为
的电子式为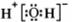
B.4℃时,纯水的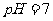
C.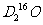 中,质量数之和是质子数之和的两倍
中,质量数之和是质子数之和的两倍
D.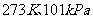 ,水分之间的平均距离
,水分之间的平均距离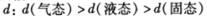
1、化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.为提高农作物的产量和质量,应大量使用化肥和农药
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.实现化石燃料清洁利用,就无需开发新能源
D.垃圾是放错地方的资源,应分类回收利用
10.(14分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)
+ CO(g)  CH3OH(g);ΔH = -90.8 kJ·mol-1
CH3OH(g);ΔH = -90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH= -23.5
kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH= -23.5
kJ·mol-1
③ CO(g) + H2O(g)
 CO2(g) +
H2(g);ΔH= -41.3
kJ·mol-1
CO2(g) +
H2(g);ΔH= -41.3
kJ·mol-1
总反应:3H2(g)
+ 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g)
 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
解析:(1)煤生成水煤气的反应为C+H2O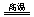 CO+H2。
CO+H2。
(2)既然生成两种酸式盐,应是NaHCO3和NaHS,故方程式为:
Na2CO3+H2S==NaHCO3+NaHS。
(3)观察目标方程式,应是①×2+②+③,故△H=2△H1+△H2+△H3=-246.4kJ· mol -1。
正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低;故选c、e。
(4)此时的浓度商Q=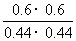 =1.86<400,反应未达到平衡状态,向正反应方向移动,故
=1.86<400,反应未达到平衡状态,向正反应方向移动,故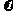 正>
正>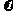 逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=
逆;设平衡时生成物的浓度为0.6+x,则甲醇的浓度为(0.44-2x)有:400=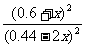 ,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。
由表可知,甲醇的起始浓度度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,
10min变化的浓度为1.6 mol·L-1,故 (CH3OH)=0.16
mol·L-1·min-1。
(CH3OH)=0.16
mol·L-1·min-1。
答案:(1) C+H2O CO+H2。
CO+H2。
(2) Na2CO3+H2S==NaHCO3+NaHS
(3) -246.4kJ· mol -1 c、e
(4) ①> ②0.04 mol·L-1 0.16 mol·L-1·min-1
命题立意:本题是化学反应原理的综合性试题,考查了化学方程式的书写、盖斯定律的应用、化学平衡移动原理,和利用浓度商和平衡常数的关系判断平衡移动的方向、平衡常数和速率的计算等。
9.(18分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl,再烘干、焙烧除去水分得到粉体TiO2 。
用现代分析仪器测定TiO2粒子的大小。用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵ 检验TiO2·x H2O中Cl-是否被除净的方法是______________________________。
⑶ 下列可用于测定TiO2粒子大小的方法是_____________________(填字母代号)。
a.核磁共振法 b.红外光谱法 c.质谱法 d.透射电子显微镜法
⑷ 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
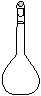



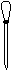

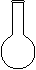

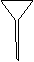

a b c d e
⑸ 滴定终点的现象是___________________________________________________。
⑹ 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
⑺ 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
解析:(1)设TiCl4的系数为1,根据元素守恒,TiO2·xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x)。
(2)检验沉淀是否洗净的方法是,取少量洗涤液,检验溶液中溶解的离子是否还存在。
(3)核磁共振谱用于测有机物中含有多少种氢原子;红外光谱分析有机物含有何种化学键和官能团;质谱法常用于测有机物相对分子质量;透射电子显微镜可以观察到微粒的大小。
(4)NH4Fe(SO4)2易水解,故需加入一定量的稀硫酸抑制水解;配制一定物质的量浓度的溶液,还需要容量瓶和胶头滴管。
(5)因为是用KSCN作指示剂,终点时NH4Fe(SO4)2不再反应,生成血红色的Fe(SCN)3。
(6)根据得失电子守恒,有:1Ti3+-1Fe3+,故n(Fe3+)= n(Ti3+)= n(TiO2)=cV×10-3mol,其质量分数为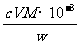 。
。
(7) NH4Fe(SO4)2溶液溅出,其物质的量浓度减小,消耗的体积增大,百分含量偏大;若终点俯视滴定管,读取的体积比实际消耗的体积偏小,质量分数偏小。
答案:
(1) TiCl4+(2+x) H2O TiO2·xH2O+4HCl
TiO2·xH2O+4HCl
(2)取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净。
(3)d
(4)抑制 NH4Fe(SO4)2水解 a c
(5)溶液变成红色
(6)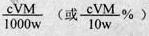
(7)偏高 偏低
命题立意:本题是围绕化学实验设计的综合性试题,主要考点有:化学方程式配平、沉淀的洗涤、颗粒大小的测量方法,和溶液的配制、滴定操作及误差分析,质量分数的计算等。
8.(18分)Ⅰ.已知:R-CH=CH-O-R′ 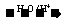 R-CH2CHO + R′OH
R-CH2CHO + R′OH
(烃基烯基醚)
烃基烯基醚A的相对分子质量(M r)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
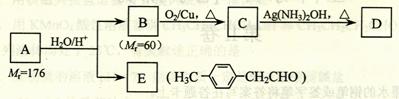
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B的名称是___________________;A的结构简式为________________________。
⑶ 写出C → D反应的化学方程式:_______________________________________。
⑷ 写出两种同时符合下列条件的E的同分异构体的结构简式:
_________________________、________________________。
① 属于芳香醛;
② 苯环上有两种不同环境的氢原子。
Ⅱ.由E转化为对甲基苯乙炔(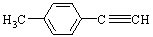 )的一条路线如下:
)的一条路线如下:
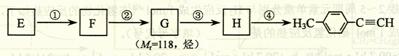
⑸ 写出G的结构简式:____________________________________。
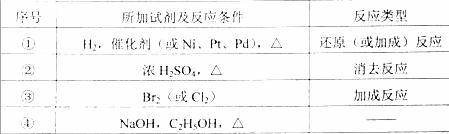
⑹ 写出① ~ ④步反应所加试剂、反应条件和 ① ~ ③ 步反应类型:
|
序号 |
所加试剂及反应条件 |
反应类型 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
-- |
解析:(1) (2)由B可催化氧化成醛和相对分子质量为60可知,B为正丙醇;由B、E结合题给信息,逆推可知A的结构简式为: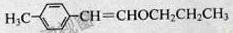 。
。
(3)C→D发生的是银镜反应,反应方程式为:
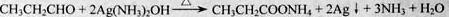
(4)符合苯环上有两种不同环境H原子的结构对称程度应较高,有:
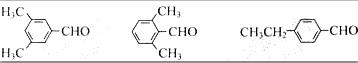 。
。
(5)(6)生成含有碳碳三键的物质,一般应采取卤代烃的消去反应,故第①步是醛加成为醇,第②步是醇消去成烯烃,第③步是与Br2加成,第④步是卤代烃的消去。
答案:
(1)C12H16O
(2) 正丙醇或1-丙醇 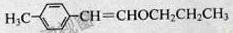
(3)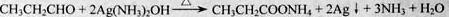
(4) 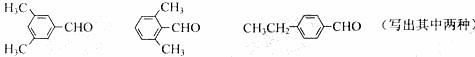
(5)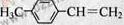
(6) 
命题立意:典型的有机推断、有机合成综合性试题,全面考查了有机分子式和结构简式的推导,结构简式和化学方程式的书写,同分异构体的判断与书写,有机合成,和有机信息的理解与应用。全面考查了学生思维能力、分析问题和解决问题的能力。
7.(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
解析:(1)X、Y、Z、L是组成蛋白质的四种元素且原子序数依次增大,故分别为:H、C、N、O元素;M是地壳中含量最高的元素,为Al,其在周期表的位置为第3周第ⅢA族;再根据五种元素在周期表的位置,可知半径由大到小的顺序是:Al>C>N>O>H。
(2) N和H 1:3构成的分子为NH3,电子式为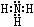 ;2:4构成的分子为N2H4,其结构式为
;2:4构成的分子为N2H4,其结构式为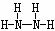 。
。
(3)Se比O多两个电子层,共4个电子层,1→4电子层上的电子数分别为:2、8 、18、6,故其原子序数为34;其最高价氧化物对应的水化物的化学式类似H2SO4,为H2SeO4。
非金属性越强,与氢气反应放出的热量越多,故2→5周期放出的热量依次是:d、c、b、a,则第四周期的Se对应的是b。
(4)Al作阳极失去电子生成Al3+,Al3++3HCO3-==Al(OH)3+3CO2,2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
答案:
(1)O 第三周第ⅢA族 Al>C>N>O>H
(2) 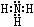
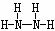
(3) 34 H2SeO4 b
(4) Al-3e-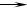 Al3+
Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3
Al3+
Al3++3HCO3-==Al(OH)3+3CO2 2Al(OH)3 Al2O3+3H2O。
Al2O3+3H2O。
命题立意:本题以元素的推断为背景,综合考查了元素符号的书写、元素位置的判断和原子半径大小的比较;考查了电子式、结构式的书写,元素周期律,和电极反应式、化学方程式的书写,是典型的学科内综合试题。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com